经过多年的延迟FDA批准了Teva的通用EpiPen
2021年7月5日,北京大学生命科学学院、北大-清华生命科学联合中心伊成器教授团队与北京大学化学与分子工程学院高毅勤教授团队在Nature Communications合作发表题为“DNA repair glycosylase hNEIL1 triages damagedbases via competing interaction modes”的论文,揭示了DNA糖基化酶hNEIL1识别并修复多种不同类型碱基损伤的分子机制。
hNEIL1是碱基切除修复途径中一个关键的DNA糖基化酶,它可以修复十多种结构迥异的DNA碱基损伤。遗憾的是,人们对hNEIL1的底物识别机制还所知甚少,尤其是hNEIL1如何特异性识别这些不同类型的底物,同时却又能避免细胞内大量存在的正常DNA被错误切除。研究人员利用活性位点突变和底物修饰两种策略,鉴定到一种全新的hNEIL1-DNA作用模式。在该模式下,hNEIL1蛋白无法发挥糖基化酶活性行使催化功能,因而底物能够被临时地保护起来。分子动力学模拟对酶-底物结构动态的分析表明,hNEIL1能够依靠两种竞争性构象的相互转变来感知底物的类型。基于这一模型,研究人员采用理性设计实现了对hNEIL1-DNA结合状态的人为操控以及hNEIL1突变体生化活性的恢复。研究人员揭示了RNA编辑影响hNEIL1酶学特性的机制,并提出这一编辑事件能够在分子层面调控DNA损伤修复的效率和准确性。
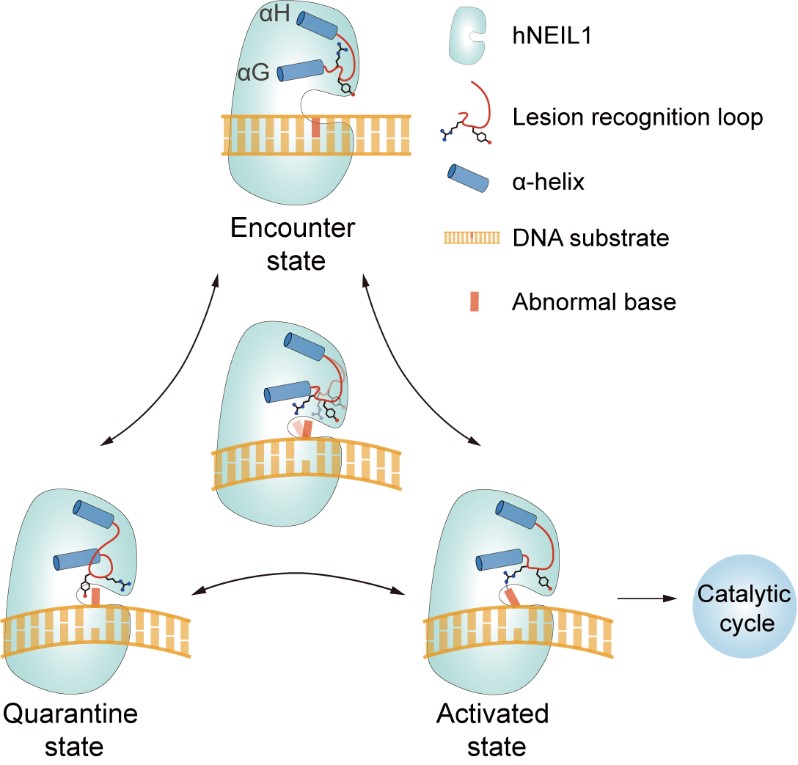
hNEIL1的底物识别模型
总的来讲,本研究综合利用结构生物学、生物化学及计算化学等多重手段,系统诠释了DNA糖基化酶中存在的一种全新的损伤修复机制。由于hNEIL1蛋白的功能异常与包括癌症在内的多种疾病密切相关,这项研究有望在未来助力相关小分子药物的开发。此外,本研究中提出的“分类筛选”模型也为人们理解细胞内其它类似酶的底物识别机制提供了一个示例。
伊成器、高毅勤为本文的共同通讯作者。生命科学联合中心刘梦豪博士、化学学院张骏博士以及生命学院朱晨旭博士为本文共同第一作者。该研究得到国家自然科学基金、霍英东教育基金和北大-清华生命科学联合中心的资助。
-
合成微生物使科学家们能够研究古老的进化神秘
2022-04-29 -
加强了恰帕斯高地土着居民的领土管理合作进程
2022-04-29 -
介绍CNVP,IUCN的新成员
2022-04-29 -
销售人员为肥胖客户推荐更多圆形产品
2022-04-29 -
黄石麋鹿的疾病隐藏成本 USU生态学家说 布鲁氏菌病会减少怀孕
2022-04-29 -
研究人员设计“智能”表面以排斥一切 但针对有益的例外
2022-04-29 -
大麻使用的性别差异开始在动物和人类的大脑研究的帮助下得到解释
2022-04-29 -
缅甸开始在全国红色名单上工作
2022-04-29 -
转染市场五年后将达到10亿美元
2015-07-08















