经过多年的延迟FDA批准了Teva的通用EpiPen
分裂细胞的细胞膜沿着中心凹陷,将细胞分裂成两个几乎一模一样的子细胞。现在用聚焦的蓝光照射分裂细胞的两极,你会发现膜的崩裂加快了。只要用一盏灯照射一根杆子,子细胞就会变形。
细胞如何呈现独特的形状、移动、分裂和组织,是由细胞内部的机械力量来控制的。这些机械力是由肌动蛋白丝和非肌凝蛋白II产生的。肌动蛋白丝在细胞皮层(细胞膜正下方的区域)形成一个薄薄的网络,而非肌凝蛋白II与肌动蛋白网交联形成肌动球蛋白复合体。
“为了理解细胞如何产生力量和塑造其形态,解开肌动球蛋白的作用模式是至关重要的,”一篇题为“Optogenetic relaxation of actomyosin contractility uncovers mechanistic roles of cortical tension during cytokinesis,”的文章的作者写道。最近发表在《自然通讯》杂志上。
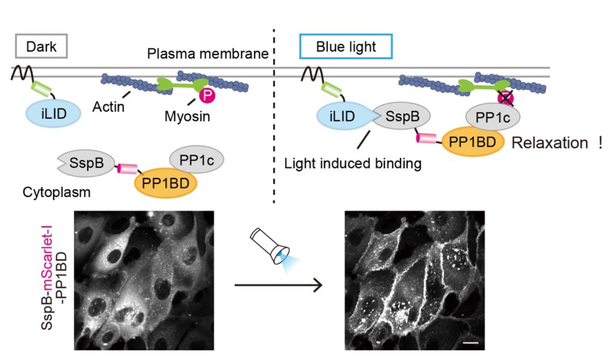
该研究报告了一种新的光遗传工具的设计和开发,该工具使用蓝光来通过抑制其收缩力来放松细胞张力。这种名为OptoMYpT的工具是由日本国家基础生物学研究所(NIBB)定量生物学部门的一个研究团队开发的。
“我们相信,OptoMYpT将有助于理解涉及肌动球蛋白细胞骨架的各种胚胎学和细胞生物学现象,”NIBB教授和该文章的资深作者Kazuhiro Aoki博士说。“在未来,我们希望它可以用于自由设计细胞和组织的形状,以及形成人工器官。”
该工具旨在灭活负责肌动球蛋白收缩性的非肌肉肌凝蛋白II。为了实现这一目标,科学家们使用了一种名为MYpT1的蛋白质,它可以灭活肌凝蛋白。MYpT1使磷酸酶pp1c靠近肌球蛋白,导致肌球蛋白脱磷酸化和失活。研究人员利用光通过MYpT1的pp1c结合域(pp1BD)来操纵pp1c在细胞中的位置。
该论文的第一作者、研究生Kei Yamamoto表示:“我们使用了一种名为iLID的工具,通过光来控制蛋白质的定位。该工具基于蓝光照射导致iLID蛋白与SspB蛋白结合的想法。首先,iLID蛋白定位于细胞膜上,而SspB与MYpT1的pp1BD融合后在细胞质内表达。蓝光照射通过与iLID结合诱导SspB-pp1BD从细胞质转位到膜上,导致内源性pp1c共同招募到膜上。最后,膜吸收的pp1c去磷酸化并使细胞膜附近的肌球蛋白失活。”
作者指出,在哺乳动物细胞和青蛙胚胎上照射蓝光足以使肌球蛋白去磷酸化和失活,从而降低细胞的收缩力。
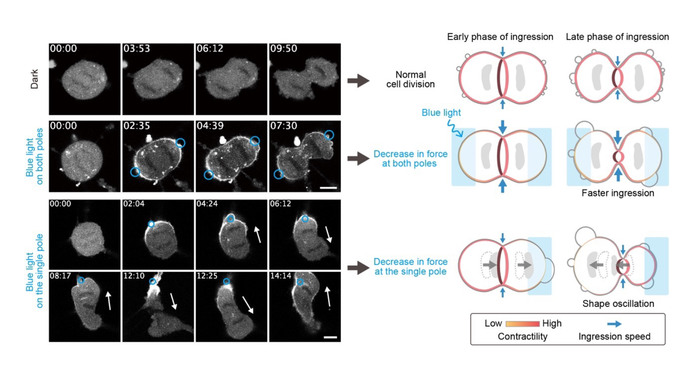
该团队随后应用OptoMYpT来了解细胞分裂的机制。他们发现,在分裂细胞的两极局部发出蓝光会减弱细胞皮层的张力,从而加快细胞分裂的速度。
作者指出:“我们发现,通过OptoMYpT,皮层张力在两极的松弛加速了沟的入沟率,这表明皮层张力在很大程度上拮抗了解理沟的收缩。”
当研究人员只减弱分裂细胞一侧细胞皮层的张力时,两个子细胞之间就会发生细胞质振荡流动,导致它们变形。这表明,使用OptoMYpT扰动局部机械力破坏了细胞拉伸力的对称性,这在细胞分裂的进程中是关键的。
OptoMYpT在理解细胞分裂机制方面的生产性应用表明,该工具可以用于探测细胞和组织力学。作者指出,结合红蓝光感应光遗传工具,可以通过局部改变细胞和组织的收缩力来创造复杂的细胞形状。
-
合成微生物使科学家们能够研究古老的进化神秘
2022-04-29 -
加强了恰帕斯高地土着居民的领土管理合作进程
2022-04-29 -
介绍CNVP,IUCN的新成员
2022-04-29 -
销售人员为肥胖客户推荐更多圆形产品
2022-04-29 -
黄石麋鹿的疾病隐藏成本 USU生态学家说 布鲁氏菌病会减少怀孕
2022-04-29 -
研究人员设计“智能”表面以排斥一切 但针对有益的例外
2022-04-29 -
大麻使用的性别差异开始在动物和人类的大脑研究的帮助下得到解释
2022-04-29 -
缅甸开始在全国红色名单上工作
2022-04-29 -
转染市场五年后将达到10亿美元
2015-07-08















