经过多年的延迟FDA批准了Teva的通用EpiPen
2022年2月10日,浙江大学生命科学学院易文教授课题组在Journal of the American Chemical Society在线发表了题为“Spatiotemporal Activation of protein O-GlcNAcylation in Living Cells” 的研究论文。该论文还入选下一期杂志的封面文章。该研究报道了一种利用光脱笼激活方法,在活细胞内实现蛋白糖基化修饰的时空分辨的动态调控。
选择性地操纵细胞内蛋白质功能的研究方法是研究蛋白质的重要工具。目前,光激活策略作为一种功能获得型的研究方法,近年来获得了广泛的关注。其主要原理是使用光笼(photocaged)非天然氨基酸替换目标蛋白的关键活性位点,令蛋白在未光照激活的条件下处于失活状态;随后,经光照激活,光笼小分子离去,蛋白质的功能得以恢复。这种方法具有极高的时空可控性以及极高的效率。
N-乙酰葡糖胺修饰(O-GlcNAc)是共价连接到蛋白质的丝氨酸或苏氨酸羟基上的一种普遍的糖基化修饰。研究表明,O-GlcNAc修饰在控制蛋白质功能方面发挥着关键作用,包括亚细胞定位、蛋白质稳定性、蛋白质相互作用等。O-GlcNAc修饰在细胞内仅由一对酶进行可逆地调控,分别是O-GlcNAc糖基转移酶(OGT)和O-GlcNAc水解酶(OGA)。目前对于O-GlcNAc修饰的研究都是基于小分子抑制剂或者基因敲除,缺乏从时空上对该修饰进行调节的策略。本研究开发了一种基于遗传密码扩增技术对OGT关键活性位点(K842)进行暂时失活的光笼OGT(ph-OGT),利用紫外光进行光解去除光笼小分子后,OGT的活性得到了恢复。之后结合定量蛋白质组学,作者鉴定了在不同时间点被激活的糖蛋白,显示细胞内不同蛋白具有不同的糖基化动态速率。作者进而利用该光控激活策略操纵了成纤维细胞的形态变化。最后,作者还结合OGT的胞内定位机制,实现了在细胞质特异性的糖基化调控。

浙江大学生命科学学院易文课题组博士研究生何佳辉为该论文第一作者。易文教授为该论文的通讯作者。
原文链接:https://pubs.acs.org/doi/10.1021/jacs.1c11041
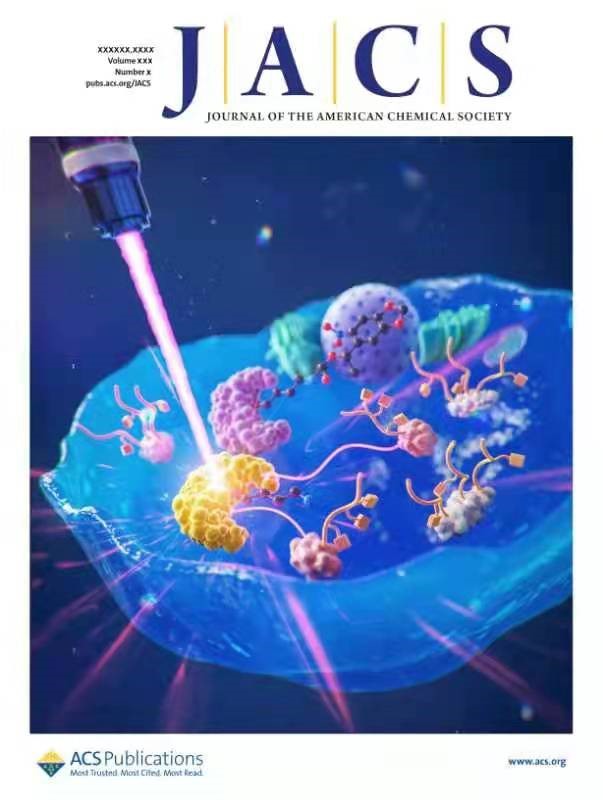
(本论文入选JACS下一期的前封面文章)
-
合成微生物使科学家们能够研究古老的进化神秘
2022-04-29 -
加强了恰帕斯高地土着居民的领土管理合作进程
2022-04-29 -
介绍CNVP,IUCN的新成员
2022-04-29 -
销售人员为肥胖客户推荐更多圆形产品
2022-04-29 -
黄石麋鹿的疾病隐藏成本 USU生态学家说 布鲁氏菌病会减少怀孕
2022-04-29 -
研究人员设计“智能”表面以排斥一切 但针对有益的例外
2022-04-29 -
大麻使用的性别差异开始在动物和人类的大脑研究的帮助下得到解释
2022-04-29 -
缅甸开始在全国红色名单上工作
2022-04-29 -
转染市场五年后将达到10亿美元
2015-07-08















