肿瘤释放乳酸,迫使附近的细胞发挥支持作用
视频:在激光扫描显微镜下,活细胞内er定位的聚集探针的高分辨率三维重建。探测器发出的光根据其荧光寿命以热图颜色编码,使其聚集物明显,因为它们有较长的寿命,使它们在正常短寿命的背景上显示为黄红色,而正常短寿命则显示为绿色。
图片来源:剑桥大学
人们常说一点压力对你有好处。现在,科学家们已经表明,细胞也可能是同样的情况,揭示了一种新发现的机制,可能有助于防止在痴呆症中常见的蛋白质缠结的堆积。
阿兹海默症和帕金森氏症等统称为神经退行性疾病的疾病的一个特征是错误折叠蛋白质的堆积。这些蛋白质,比如阿尔茨海默病中的淀粉样蛋白和tau蛋白,会形成“聚集体”,对大脑中的神经细胞造成不可逆转的损害。
蛋白质折叠在人体内是一个正常的过程,在健康的个体中,细胞进行一种形式的质量控制,以确保蛋白质正确折叠,而错误折叠的蛋白质被破坏。但在神经退行性疾病中,这个系统会受到损害,可能带来毁灭性的后果。
随着全球人口老龄化,越来越多的人被诊断为痴呆症,使寻找有效的药物变得更加迫切。然而,进展缓慢,目前还没有药物可以防止或消除聚集物的积累。
在今天发表在《自然通讯》(Nature Communications)上的一项研究中,剑桥大学英国痴呆症研究所的科学家们领导的一个团队发现了一种新的机制,似乎可以逆转聚集物的积累,不是通过完全消除它们,而是通过“重新折叠”它们。
剑桥大学英国痴呆研究所的爱德华·阿维佐夫博士解释说:“就像我们因繁重的工作而感到压力一样,如果细胞被要求生产大量的蛋白质,它们也会感到‘压力’。”
“造成这种情况的原因有很多,例如当它们产生抗体以应对感染时。我们专注于应激一种被称为内质网的细胞成分,它负责产生我们大约三分之一的蛋白质,并假设这种应激可能会导致错误折叠。”
内质网(ER)是在哺乳动物细胞中发现的一种膜结构。它执行许多重要的功能,包括合成、折叠、修饰和运输细胞表面或外部所需的蛋白质。阿维佐夫博士和他的同事们假设,应激ER可能会降低蛋白质正常功能的能力,从而导致蛋白质的错误折叠和聚集,从而导致聚集增加。
他们惊讶地发现事实正好相反。
阿维佐夫博士说:“我们惊讶地发现,对细胞施加压力实际上消除了聚集体——不是通过降解或清除它们,而是通过拆开聚集体,可能使它们正确地折叠。”
“如果我们能找到一种方法,在不给细胞带来压力的情况下唤醒这种机制——这可能会造成更多的损害,而不是好处——那么我们可能就能找到治疗某些痴呆症的方法。”
这一机制的主要组成部分似乎是一种被称为热休克蛋白(HSps)的蛋白质,当细胞暴露在高于正常生长温度的温度下,并在应激反应时,会产生更多的热休克蛋白。
阿维佐夫博士推测,这可能有助于解释痴呆症研究领域中一个更不寻常的观察结果。“最近有一些关于斯堪的纳维亚国家经常使用桑拿的人的研究表明,他们患痴呆症的风险可能更低。一种可能的解释是,这种轻微的压力触发了HSps的更高活性,帮助纠正缠结的蛋白质。”
以前阻碍这一领域研究的因素之一是无法在活细胞中观察这些过程。该团队与来自宾夕法尼亚州立大学和阿尔加维大学的团队合作,开发了一种技术,使他们能够检测活细胞中的蛋白质错误折叠。它依赖于在纳秒(十亿分之一秒)尺度上测量一种发光化学物质的光模式。
该研究的主要作者之一、来自葡萄牙阿尔加维大学的爱德华多·梅洛教授说:“在激光显微镜下以纳秒尺度测量我们的探测器的荧光寿命,让细胞内原本不可见的聚集物变得明显起来,这很有趣。”
Stress-induced protein disaggregation in the Endoplasmic Reticulum catalysed by Bip.
-
细菌沿着直线逃离狭小的空间
2022-07-26 -
新方法:在常规临床基因组测序分析中轻松识别肿瘤中的病毒
2022-07-26 -
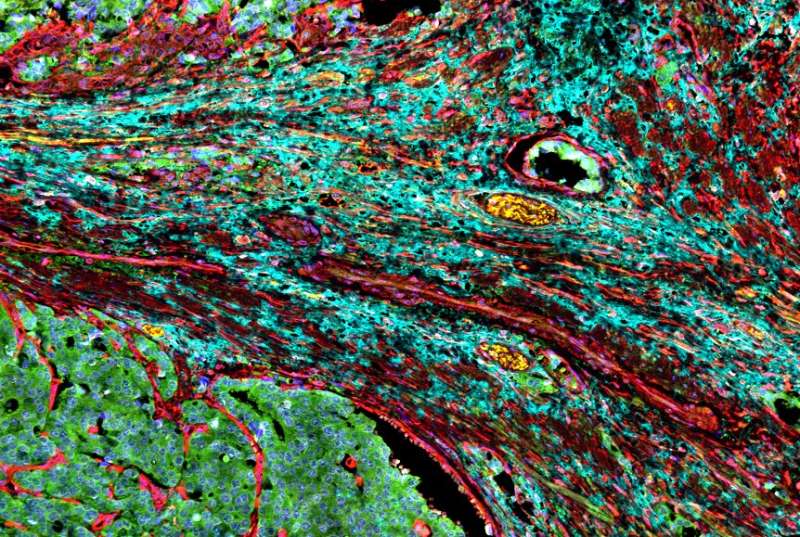
颈动脉斑块内的个体免疫细胞特征
2022-07-26 -
免疫系统癌症研究综述
2022-07-26 -
Nature子刊:根据大量神经成像数据预测大脑年龄
2022-07-26 -
将时间从几个月缩短到几周:一种新的基因传递方法
2022-07-26 -
《Science》四篇论文:绘制人类33个器官中的百万细胞
2022-07-26 -
Nature子刊:线粒体呼吸链维持炎症
2022-07-26 -
Nature子刊:基于电子病历预测心理健康危机的机器学习模型
2022-07-26 -
解决30年难题:科学家发现新的蛋白质结构,帮助合理设计药物
2022-07-26