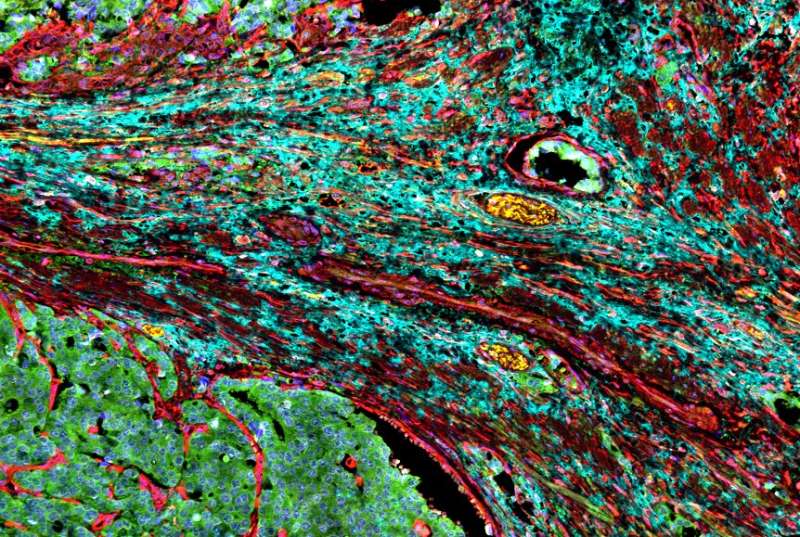
肿瘤释放乳酸,迫使附近的细胞发挥支持作用
2022年7月15日,浙江大学生命科学学院赵烨教授、华跃进教授联合浙江大学医学院郭江涛教授团队在Cellpress旗下的Structure杂志发表了题为“Mechanisms of helicase activated DNA end resection in bacteria”的研究成果。该论文使用冷冻电镜首次解析了细菌中的损伤DNA末端降解复合体HerA-NurA完整八聚体复合物的结构,并结合生化实验发现NurA延伸到中央孔径的N端区域(ENR)调节了HerA-NurA的解旋酶和核酸酶活性,揭示了细菌中有别于古菌的DNA末端切除机制。

内源性和外源性的胁迫会造成各种类型的DNA损伤,其中DNA双链断裂(DSB)被认为是最为严重的一种DNA损伤类型,如不能及时修复将极大的影响基因组的稳定性,导致早衰,恶性肿瘤等重大疾病的发生。同源重组修复途径是DSB修复的重要方式之一,其首先依赖于对损伤DNA的末端降解步骤(end resection),即在解旋酶和核酸酶的协同作用下切割产生突出的单链DNA,其被用于同源修复模板的搜索,并在链侵入和链交换后由一系列的蛋白质完成后续的修复过程。耐辐射球菌(Deinococcus radiodurans)是一类耐受强烈电离辐射、化学诱变剂等压力胁迫的极端微生物,具有强大的DNA损伤修复能力以及较好的应用潜力,是目前研究DNA损伤修复的模式生物之一。
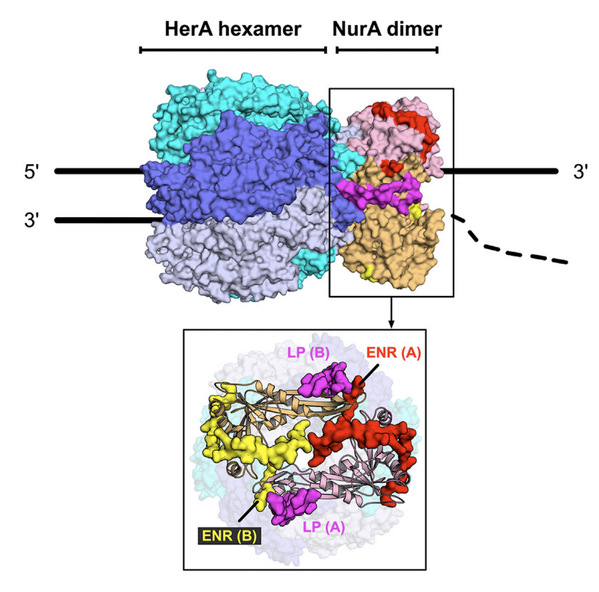
图:耐辐射球菌HerA-NurA完整八聚体结构示意图
在古菌的损伤DNA末端切除过程中,核酸酶NurA和双向解旋酶HerA能够与Mre11-Rad50复合体共同工作。然而HerA-NurA协同工作,特别细菌中该套系统的作用机制仍不清楚。本研究通过单颗粒冷冻电镜技术得到了HerA-NurA八聚体复合物的完整结构:底部的HerA具有直径约为25 ?的中央孔径,可容纳双链DNA的进入。顶部的核酸酶NurA则所具有独特的延伸N端区域(the Extended N-terminal Region,ENR),其参与了复合体的组装过程并将DNA的出口切分为两个对称的部分。进一步的通过生化实验,研究结果表明该区域参与了HerA-NurA复合物的解旋酶和核酸酶活性的调控。这些研究结果为细菌中的损伤DNA末端降解过程提供了结构基础,也为解旋酶和核酸酶的相互作用/激活机制提供了一种新的模式。
浙江大学生命科学学院博士生徐颖和浙江大学医学院博士后徐令怡为本研究论文的共同第一作者。该研究得到国家重点研发计划、国家自然科学基金资助、浙江大学癌症研究院以及浙江大学冷冻电镜中心张兴教授的帮助。
原文链接:https://www.cell.com/structure/fulltext/S0969-2126(22)00236-2
-
新发现的人类严重基因缺陷,增加了死于疫苗和简单病毒感染的风险
2022-07-26 -
重编程技术让受损的肝组织更快修复
2022-07-26 -
运动如何对抗糖尿病损害的新证据
2022-07-26 -
细胞重编程改善小鼠肝脏再生
2022-07-26 -
再见了,活检——手持设备可以毫无痛苦地识别皮肤癌
2022-07-26 -
国际研究发现,近13%的COVID-19住院患者有严重的神经症状
2022-07-26 -
作为潜在的神经治疗手段,光遗传学作用可能被夸大了
2022-07-26 -
服用抗生素后肠道菌群会发生什么变化?
2022-07-26 -
细菌沿着直线逃离狭小的空间
2022-07-26 -
新方法:在常规临床基因组测序分析中轻松识别肿瘤中的病毒
2022-07-26