经过多年的延迟FDA批准了Teva的通用EpiPen
Shuibing Chen花了近两个月的时间来照顾她的小肺——大约有50万。每一个看起来都像一个小小的风暴云,安置在一个温暖的盘子里,由一个果冻状的圆顶保护。Chen是纽约市威尔康奈尔医学院的干细胞生物学家,她和她的团队从人体细胞群中培育它们,在它们长成3D气囊的过程中每隔几天添加营养物质。
这些肺类器官逐渐成熟,直到达到小扁豆的大小。然后,研究小组把它们打包,运到几个街区外的一个实验室,该实验室被授权研究导致COVID-19大流行的SARS-CoV-2病毒。在那里,类器官被浸泡在病毒中,每一种都被浸泡在15000种药物中的一种。几乎所有的小肺都死亡了,但一些药物阻止了感染——这代表了COVID-19的少数几种可能的治疗方法。
Shuibing Chen是众多受到大流行推动的细胞生物学家之一,大流行推动了研究传染病的类器官技术的边界。在过去的一年里,研究人员创造了微型肺、内脏、肝脏、大脑等,以研究SARS-CoV-2如何感染器官。他们已经了解了病毒攻击的目标细胞、攻击的速度以及细胞如何进行反击。
荷兰乌得勒支Hubrecht研究所的发育生物学家Hans Clevers说:“类器官已经进入了病毒学家的工具箱。该技术以前主要用于研究基本的人类生物学、发育和相关疾病以及癌症,只有少数几个实验室使用该模型来研究病毒和其他传染病。但是,大流行已经把类器官带入了中心舞台,激发了具有高影响力的论文,并证明了它们对药物开发的价值。”
它们是一个受欢迎的补充,因为目前研究病毒的方法有几个局限性。病毒学的典型工具是从非洲绿猴(Chlorocebus sabaeus)的肾脏中提取的一个癌细胞系,大约60年前首次提取,并一直在分裂。这些被称为Vero细胞的细胞非常适合病毒生长,但不能反映人体正常的抗病毒反应。马萨诸塞波士顿大学的病毒学家Elke Mühlberger说,他们“真的搞砸了”。研究人员也使用了一些癌细胞系,但与Vero细胞类似,它们对感染不像正常细胞那样有反应。
虽然研究人员现在已经确定了研究新的抗病毒药物的类器官的潜在相关性,但他们的工作尚未导致有市场的治疗。Clevers说:“尽管如此,类器官技术从大流行中获得的好处比治疗COVID-19从类器官技术中获得的好处更多。”
为了充分发挥这项技术的潜力,科学家们仍然需要找到培育更复杂系统的方法,例如添加免疫细胞和血管。研究人员还需要简化生产过程,以便快速、廉价地制造出数千种(如果不是数百万种的话)统一的类器官。
香港大学病毒学家Jie Zhou说:“利用类器官来研究病毒还处于起步阶段。”
无法培养的病毒在开始研究类器官之前,病毒学家Mary Estes依靠一种更为混乱的方式来研究传染性极高的诺如病毒。没有人能在实验室里培育病毒。因此,为了她的研究,她只能从那些愿意摄入它并承受其后果的人的粪便中提取这些病毒。
2011年,她看到了Clevers的一篇论文。在这篇论文中,Clevers用刮去肠绒毛的干细胞培育出迷你肠子。Clevers创造了第一个从成体干细胞中提取的类器官,这些细胞在正确的条件下几乎可以无限生长,并且可以将自身构造成反映其器官来源的复杂结构。已经从胚胎干细胞或诱导多能干细胞(ipS)细胞中提取出了类器官,这些细胞可以发育成任何类型的细胞,但它们通常反映的是胎儿发育早期的器官。
“我想——好吧,这看起来像是一个我们应该尝试的系统,”Estes说,她在德克萨斯州休斯顿的贝勒医学院工作。“当时没有人把这些培养物用于病毒学。”
2016年,在诺如病毒被发现近半个世纪后,Estes成为第一个在培养皿中培育人类诺如病毒的人,这种方法可以在肠道类器官中复制。
她的研究证明类器官是人类疾病的一个很好的模型。例如,她发现,诺如病毒的变种在那些通常不会因该病毒而患病的人的细胞制造的类器官中根本不复制。
此后,研究人员使用类器官研究了更多的病毒,包括呼吸道合胞病毒(RSV)——儿童肺部感染的常见原因——气道类器官,以及肾脏类器官中罕见而神秘的BK病毒。
2016年,一个团队用寨卡病毒感染了正在发育的脑类器官,并建立了孕妇感染与小头畸形之间的联系。小头畸形是指胎儿的头部异常小。感染后10天,脑类器官比未感染的小40%。巴西里约热内卢联邦大学神经生物学家patricia Garcez领导了这项工作,她说,这些神经祖细胞是“寨卡病毒感染的沃土”。
2018年,Zhou、Clevers和他们的同事开发了一种肺部类器官,可用于快速评估一种新型流感病毒的传染性。已知对人具有高度传染性的毒株,包括导致2009年H1N1流感大流行的毒株,在类器官中复制的速度比通常感染猪和鸟的毒株快得多。
除了这些例子,当SARS-CoV-2出现并引起他们的注意时,很少有病毒学家对类器官进行过实验。
没过多久,Clevers就认识到他的类器官模型在研究流行病中不熟悉的病毒方面的潜力。Clevers说,有明显的迹象表明,这种病毒可能会影响肠道,尤其是儿童。他想知道是否可以用他的肠道类器官来观察病毒是否可以感染肠道组织。
2020年3月15日,也就是荷兰封锁的那天,他向鹿特丹的同事索要了SARS-CoV-2的样本。在7周内,他和他的同事在《Science》杂志上发表了一篇论文,表明SARS-CoV-2可以在微型肠道中轻易复制,特别是针对排列在肠道内的肠上皮细胞。这项研究有助于解释为什么一些COVID-19患者会出现腹泻和呕吐等消化问题,并确定了另一种可能的传播途径。
此后,研究人员发现,SARS-CoV-2可以感染从肝脏到肾脏再到大脑的许多微小器官,这与某些COVID-19患者的多器官损伤类似。
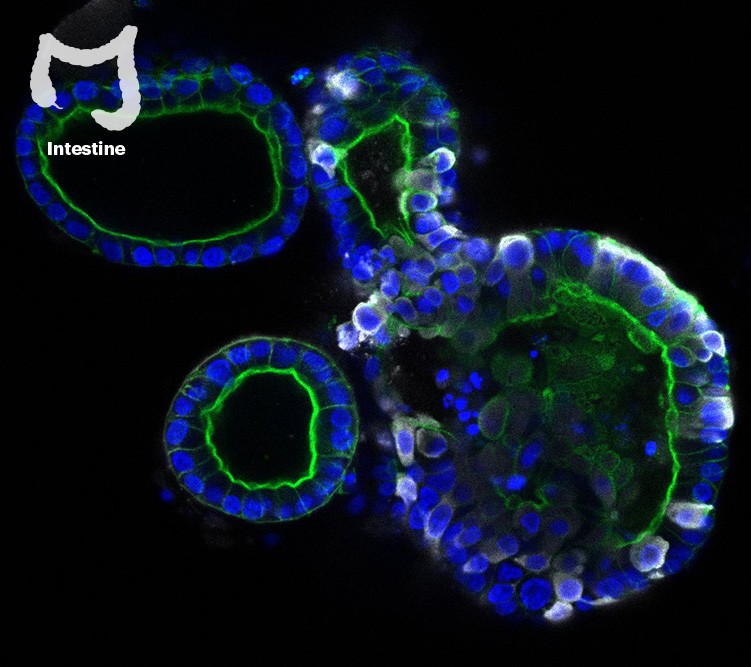
研究人员已经使用类器官来探索SARS-CoV-2如何感染细胞并寻找治疗方法。病毒(白色)感染了肠道类器官,这可以解释为什么有些人会出现COVID-19胃肠道症状。
最受关注的器官是肺,这是有充分理由的。深埋在肺部的是被称为肺泡的微小气囊——严重COVID-19患者的肺炎部位。这些细胞很难接触和研究。加州斯坦福大学的病毒免疫学家Catherine Blish和她的同事们利用自发形成这些气囊的细胞来研究感染情况。
研究人员发现,这种病毒在由肺泡和为其提供食物的微小气道细胞制造的类器官中泛滥。在肺泡中,SARS-CoV-2针对覆盖在暴露于空气表面的细胞,这些细胞富含ACE2受体,SARS-CoV-2通过ACE2受体进入。该病毒还影响了气道中的细胞,该细胞分泌一种分子,用于处理肺部的持续拉伸,称为club细胞。Blish说:“如果没有类器官,我不知道我们能不能发现club细胞可以支持SARS-CoV-2复制,因为没有人会想到把它放在club细胞上。”
对小肺泡的其他研究揭示了病毒和细胞之间战斗的细节。大田市韩国科学技术高级研究院(Korea Advanced Institute of Science and Technology in Daejeon)的基因组科学家Young Seok Ju发现,这些细胞大约需要一天的时间进行报复。细胞和病毒之间的斗争随之而来,从第三天开始,超过四分之一的细胞开始死亡。
科学家们还想知道更多关于病毒如何进入细胞的信息。在一项研究中,研究人员在肠道类器官中使用基因编辑技术CRISpR来识别另外两种蛋白质——TMpRSS2和TMpRSS4——它们与ACE2一起促进了病毒的侵入。其他实验室正在彻底消灭ACE2,看看病毒是否还能进入。“我们对类器官研究得越多,就越意识到不同类型的细胞使用不同的机制来支持病毒入侵,”Chen说。
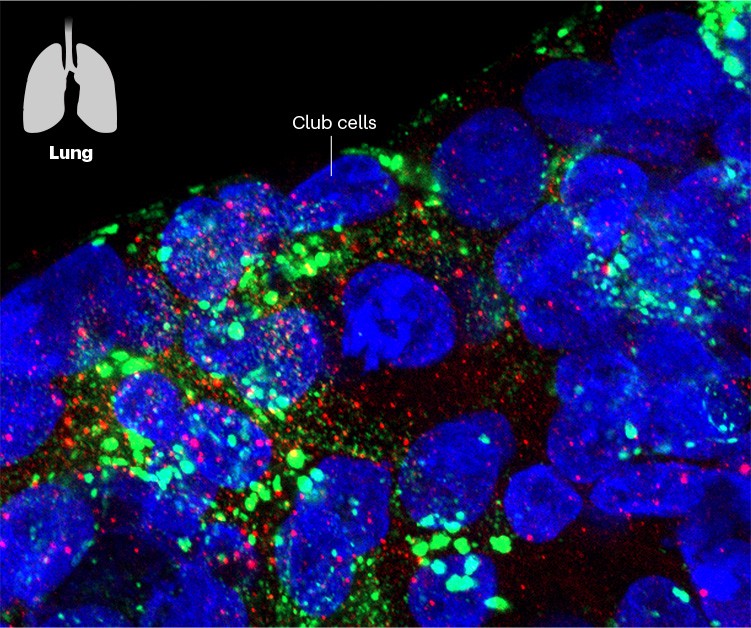
肺类器官包含的细胞是SARS-CoV-2的主要目标(红色),包括club细胞,它分泌一种保护物质。
类器官也被用于研究SARS-CoV-2的新变种。在一份预印文件中,Clevers和他的同事们研究了人类气道、肺泡和肠道类器官,发现在英国首次发现的B.1.1.7变异在感染的后期阶段可以产生比以前传播的变异更多的传染性病毒。这可能解释了为什么B.1.1.7更具传染性。
微小的扁桃体对这种病毒在人体中肆虐的直观观察可以帮助研究人员找到阻止它的方法。类器官帮助填补了在细胞系中观察病毒的差距,细胞系缺少真正的组织的复杂性,而使用动物模型,不仅与人类感染差别大而且价格昂贵,加拿大萨斯喀彻温大学的冠状病毒研究员Arinjay Banerjee计划在他的研究中使用肠道类器官。
Blish说,许多在细胞薄片中看起来很有前途的候选药物在后期往往会失败。一个显著的例子是羟氯喹,它是首批被吹捧为COVID-19治疗药物之一。对Vero细胞的研究表明,氯喹可以阻断病毒,但后来的临床试验表明,它没有保护作用。Clevers和其他人研究了SARS-CoV-2是如何感染肠道类器官的,他们发现SARS-CoV-2感染肠道类器官的途径与感染Vero细胞的途径不同。他们发现,羟基氯喹可以阻断病毒在Vero细胞中的传播途径,但在类器官中不能。“如果这些最初的药物筛选是在类器官而不是Vero细胞上进行的,氯喹就永远不会成为一个有前途的候选药物,”Clevers说。
许多研究小组正在努力实现类器官药物发现的潜力。Chen已经在小结肠和小肺上测试了大约1000种药物,并确定了7种看起来很有前景的药物,包括抗病毒药物瑞德西韦,该药物已经在临床试验中显示对参与者有一些好处。陈认为她的研究结果证明了有机筛选的实用性。
在肺类器官中进行的15000种药物筛查是她迄今为止最大的尝试。她花了数周时间调整自己的方法,以创造出尽可能相似的类器官。Chen说:“我们总是担心类器官之间的差异,就像苹果和橘子一样大。”她说,这项筛选是一个更大项目的一部分,在这个项目中,多个实验室使用不同的方法研究同一种化合物,并比较它们的结果。
类器官也被用来测试疫苗。今年1月,研究人员从手术中提取的废弃组织碎片中开发出了迷你扁桃体。扁桃体在人体的防御中起着关键作用;它们通常是第一个产生免疫细胞来对抗病原体的器官,以确保持久的保护。
当研究人员添加COVID-19候选疫苗时,一些扁桃体类器官产生免疫反应,产生杀伤T细胞,以及能够针对病毒表面刺突蛋白的抗体。但是需要做大量的工作来了解在盘子中发生的是否反映了在身体中发生的。
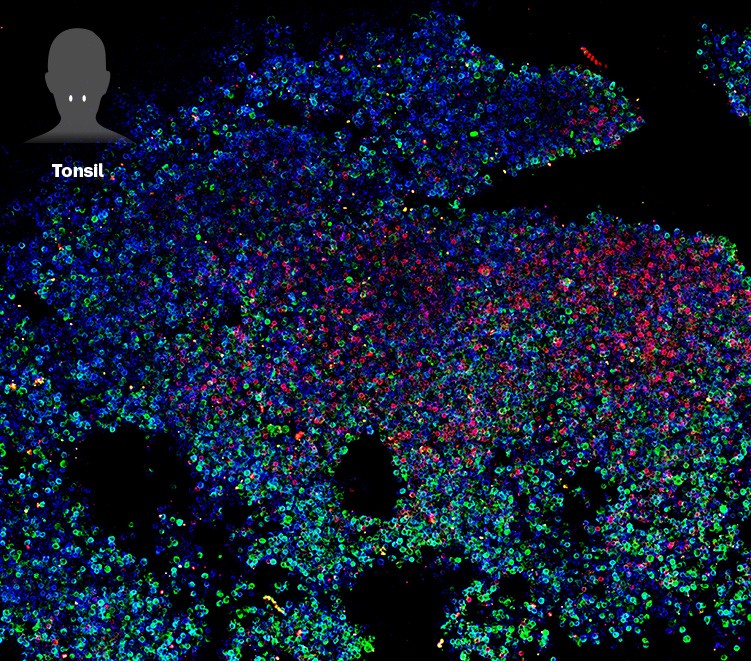
扁桃体类器官包括培养免疫细胞的区域(红色和绿色),当接触到疫苗时可以产生反应。
另外,身体的器官不是孤立存在的。为了真正了解一个人感染SARS-CoV-2后会发生什么,以及治疗是否有效,研究人员需要更复杂的系统,包括免疫细胞和血管细胞。
东京医科和牙科大学的临床科学家和干细胞生物学家Takanori Takebe在一项未发表的工作中,在肝类器官上培养血管细胞,发现较小的毛细血管和静脉比较大的血管更容易受到SARS-CoV-2感染。Chen在心肌细胞薄片上培养了一种叫做巨噬细胞的免疫细胞,并对她的肺类器官做同样的事情。这些实验,加上动物模型研究,可能有助于解决一个持续的争论,即到底是病毒本身,还是过度活跃的免疫反应,使COVID-19如此致命。
理想情况下,研究人员希望能够将类器官连接在一起。例如,这些系统可以揭示从肺部开始的感染如何影响心脏或肠道。“每个病毒学家的梦想是将不同的器官相互连接起来,”Mühlberger说。“我们越接近人体器官就越好,我们就越能了解为什么病毒具有如此高的致病性。”
2019年,Takebe连接了肝脏、胆管和胰腺的类器官,但到目前为止,没有团队发表过使用多器官模型研究SARS-CoV-2的论文。
下一个大流行细胞生物学家和病毒学家之间形成的关系可能会超越COVID-19。
对于每一个可被SARS-CoV-2感染的类器官,Mühlberger都用埃博拉病毒进行了平行实验。埃博拉病毒是一种致死出血热的病因,感染模式非常少。她发现埃博拉病毒可以感染几乎所有组织,甚至可以到达SARS-CoV-2不敢进入的地区。她说,这种能力可能是埃博拉病毒如此致命的原因。
为了预测下一次大流行,一些研究人员正转向从动物细胞中提取的类器官。
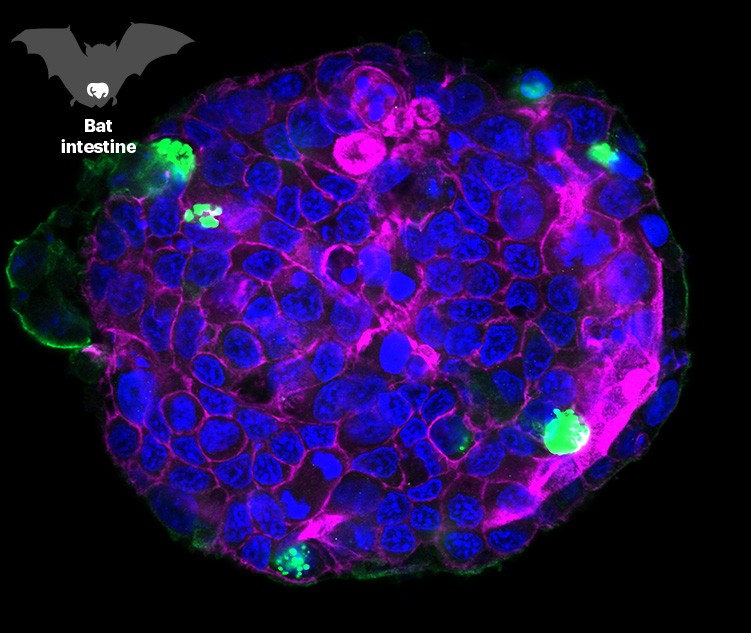
由蝙蝠组织制成的类器官可以感染SARS-CoV-2(绿色),蝙蝠是一种已知的病毒宿主。
2020年初,Zhou联系了中国武汉病毒学研究所病毒学家石正丽,石正丽帮助鉴定了SARS-CoV-2的已知最近亲属——蝙蝠冠状病毒RATG13。她说,她已经对蝙蝠的数百种冠状病毒进行了测序,但只能生长出少数几种。Zhou想知道她是否能帮助从蝙蝠组织中培养出类器官。这些技术可以用来测试针对各种可能感染人类的病毒的药物。
Zhou从野生马蹄蝠(Rhinolophus sinicus)的肠道中截取了一些片段,并创造了由多种细胞类型组成的小型蝙蝠肠道。SARS-CoV-2在肠道内生长良好——这是冠状病毒可以感染马蹄蝠的首个实验证据,为它起源于蝙蝠的假设增加了重量。
利用类器官研究病毒仍然是一项新的研究,但许多人认为它们是探索人类细胞和病毒之间相互作用的令人兴奋的模型,而且这项技术可以使对下一次大流行的反应更快。
“这些都是神奇的培养,”Estes说。“只是你的想象力限制了这个领域的发展。”
原文检索:The mini lungs and other organoids helping to beat COVID
-
合成微生物使科学家们能够研究古老的进化神秘
2022-04-29 -
加强了恰帕斯高地土着居民的领土管理合作进程
2022-04-29 -
介绍CNVP,IUCN的新成员
2022-04-29 -
销售人员为肥胖客户推荐更多圆形产品
2022-04-29 -
黄石麋鹿的疾病隐藏成本 USU生态学家说 布鲁氏菌病会减少怀孕
2022-04-29 -
研究人员设计“智能”表面以排斥一切 但针对有益的例外
2022-04-29 -
大麻使用的性别差异开始在动物和人类的大脑研究的帮助下得到解释
2022-04-29 -
缅甸开始在全国红色名单上工作
2022-04-29 -
转染市场五年后将达到10亿美元
2015-07-08















