经过多年的延迟FDA批准了Teva的通用EpiPen
许杰课题组《Journal for Immunotherapy of Cancer》揭示THADA在驱动PD-L1高尔基体驻留中的作用以及肿瘤免疫靶标价值
癌细胞中程序性死亡配体1(pD-L1)的异常上调抑制T细胞介导的细胞毒性,但驱动和维持pD-L1表达的分子机制仍不完全清楚。pD-L1在肿瘤细胞内高尔基体等细胞器的驻留可能是影响抗体药物疗效的因素之一,但既往对其理解并不充分,使免疫检查点阻断疗法面临挑战。
日前,我院许杰课题组在Journal for ImmunoTherapy of Cancer杂志发表了题为THADA drives Golgi residency and upregulation of pD-L1 in cancer cells and provides promising target for immunotherapy的研究论文,揭示了状腺腺瘤相关基因(THADA)对pD-L1在肿瘤中高尔基体等细胞器上的表达和维持过程中发挥的重要作用,并证明靶向THADA可激活CD8+ T细胞在肿瘤中的浸润并抑制肿瘤在体内的生长,这种干预方法可以与pD-L1抗体产生显著的协同治疗作用。

虽然pD-L1的阳性表达以及突变负荷较高预示肿瘤可能对pD-1/pD-L1抗体的治疗反应较好,但是仍有部分患者缺少响应。既往研究发现,部分肿瘤细胞内的高尔基体和囊泡上存在大量的pD-L1表达,其可能被转运到细胞表面并“增援”被抗体中和的靶蛋白,从而使抗体药物疗效降低。因此,揭示pD-L1在高尔基体等细胞器驻留和高表达的驱动因素,将为克服上述问题提供新的启示。
许杰课题组通过一系列的筛选验证以及分子和细胞生物学研究,发现THADA参与的外壳蛋白复合物II(COpII)转运机制介导pD-L1从内质网向高尔基体的转运,为pD-L1蛋白的充分翻译后修饰提供基础。THADA作为一种适配蛋白(adaptor protein)促进pD-L1与COpII运输囊泡上的模块SEC24A之间的相互作用,从而使pD-L1从内质网“登上”囊泡载具,运输至高尔基体进一步加工成熟(下图)。THADA在肿瘤中的上调驱动了pD-L1的高尔基体驻留和表达上调,而沉默THADA可导致pD-L1在高尔基体上的缺失,使pD-L1通过内质网相关降解(ERAD)通路被清除,但不影响MHC-I等其他膜蛋白的表达,这种效应促进了激活的T细胞杀伤肿瘤细胞的过程。
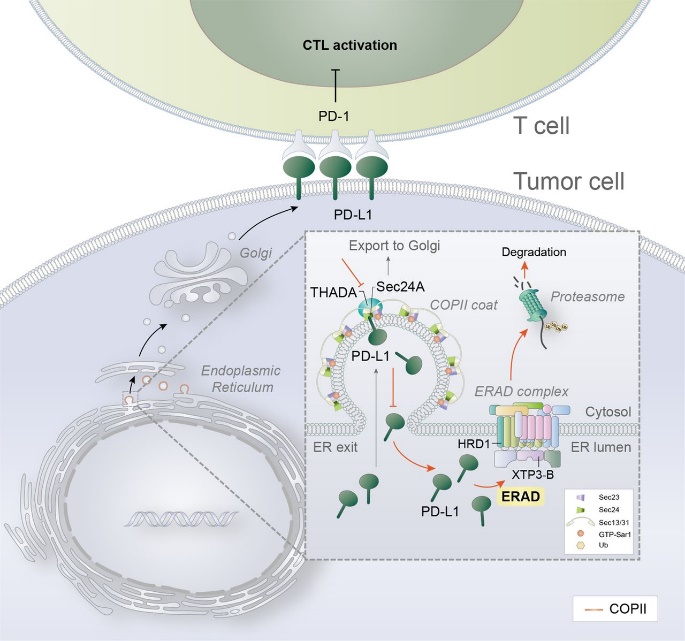
对临床组织样本的分析表明THADA的表达与pD-L1存在显著的正相关,提示THADA对pD-L1表达的驱动作用(下图)。

通过C57BL/6小鼠T细胞杀伤试验、pD-1结合试验和MC38移植瘤模型,证明抑制THADA可单独发挥抑制肿瘤生长的作用,且与pD-L1抗体联用可发挥更为彻底的肿瘤清除作用(下图)。
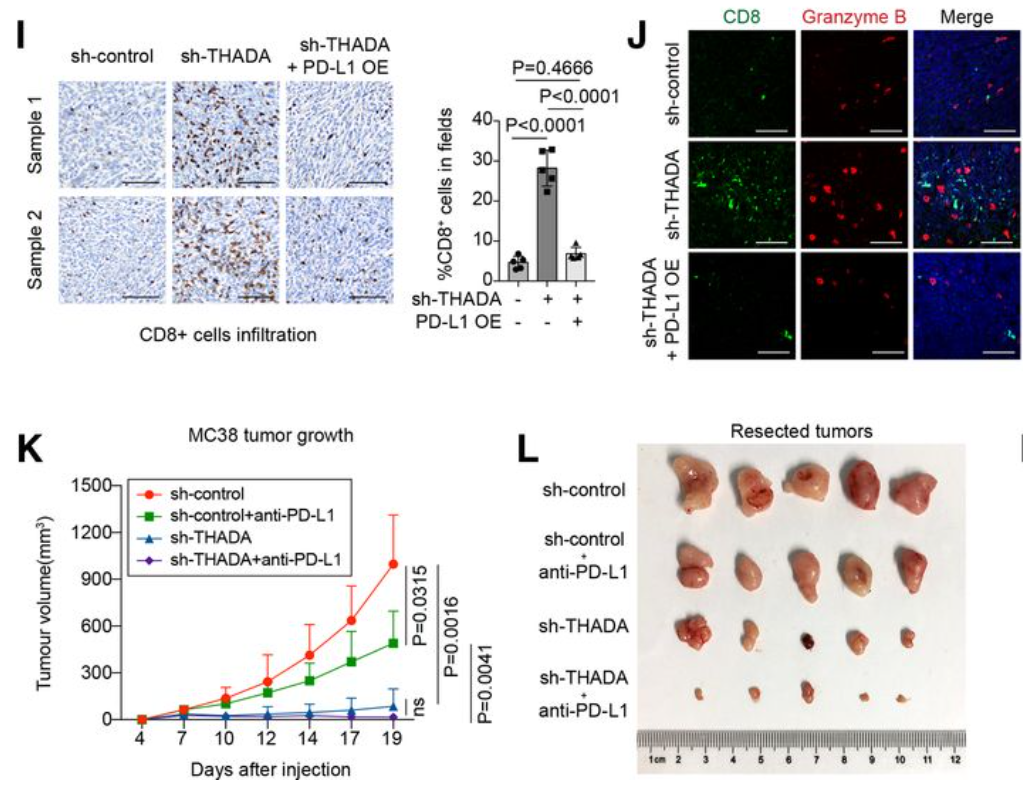
该研究揭示了肿瘤细胞中pD-L1成熟和维持的关键细胞过程,并强调THADA是克服pD-L1依赖性免疫逃避的潜在靶点。这项研究得到了国家重点研发计划、国家自然科学基金重点计划、面上计划、复旦大学科研启动基金等课题的支持。
原文链接:
https://jitc.bmj.com/content/9/8/e002443
-
合成微生物使科学家们能够研究古老的进化神秘
2022-04-29 -
加强了恰帕斯高地土着居民的领土管理合作进程
2022-04-29 -
介绍CNVP,IUCN的新成员
2022-04-29 -
销售人员为肥胖客户推荐更多圆形产品
2022-04-29 -
黄石麋鹿的疾病隐藏成本 USU生态学家说 布鲁氏菌病会减少怀孕
2022-04-29 -
研究人员设计“智能”表面以排斥一切 但针对有益的例外
2022-04-29 -
大麻使用的性别差异开始在动物和人类的大脑研究的帮助下得到解释
2022-04-29 -
缅甸开始在全国红色名单上工作
2022-04-29 -
转染市场五年后将达到10亿美元
2015-07-08















