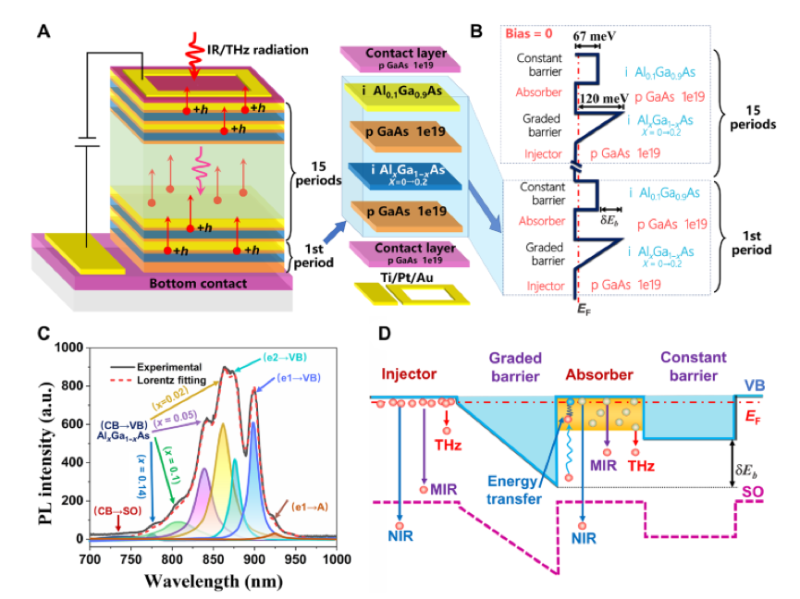
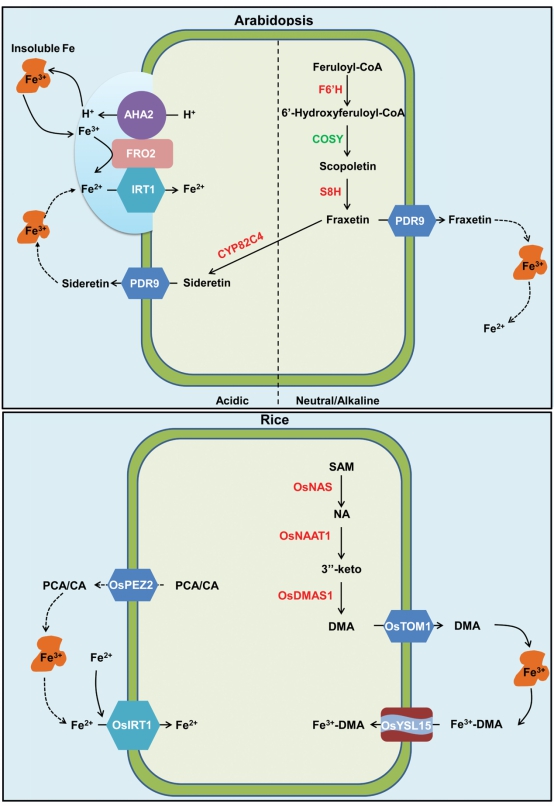
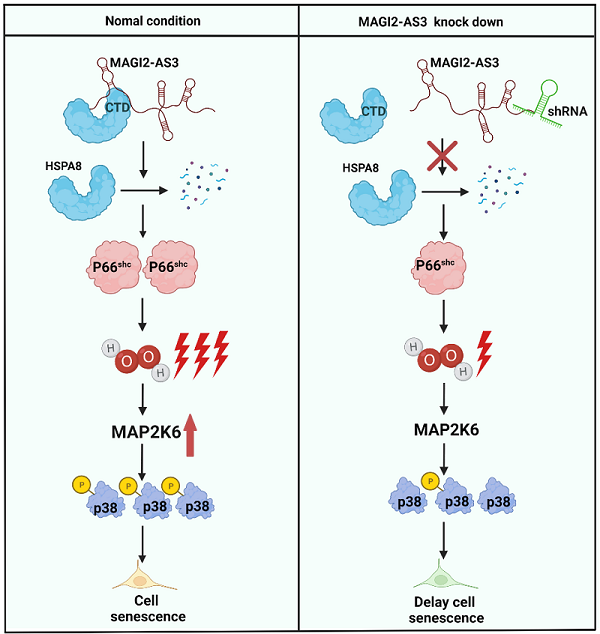
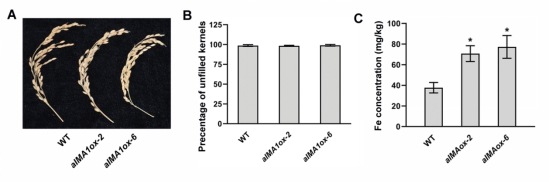
南京大学生命科学学院华子春团队发现肝纤维化的潜在治疗靶点
髓鞘是包裹在神经轴突外的一层电绝缘膜,可提高神经系统电信号的传导速率,并为神经元提供营养和代谢支持。髓鞘损伤不仅会严重影响神经系统的信号传导,从而造成视觉、感觉、运动、认知等功能性障碍,并会进一步引起神经损伤和退化,严重威胁人类健康。髓鞘损伤可见于多种神经系统疾病,包括但不限于多发性硬化症、自闭症、亨廷顿病、肌萎缩性脊髓侧索硬化症、阿尔兹海默症等。髓鞘再生修复对于患者视觉、感觉、运动、认知等功能恢复至关重要。因此,促髓鞘再生修复靶点的发现与药物研发具有十分广阔的应用前景。 2022年6月27日,中国科学院上海药物研究所谢欣课题组在Glia上发表了题为“The orphan G protein‐coupled receptor GpR149 is a negative regulator of myelination and remyelination”的研究成果,首次报道了G蛋白偶联受体(GpCR)GpR149具有调控髓鞘发育与再生的功能。  在中枢神经系统中,髓鞘由少突胶质细胞(Oligodendrocyte,OL)形成。在发育的过程中,少突胶质细胞前体细胞(Oligodendrocyte precursor cell, OpC)通过多个阶段的转变分化为成熟的少突胶质细胞。在成体中OpC也广泛存在且数量丰富。通过系统筛选表达于OpC及OL的GpCR,研究团队发现GpR149高表达于OpC,且在OpC向OL分化的过程中表达量下调,提示GpR149可能参与调控OpC的分化。 GpR149是一个孤儿受体,没有已知配体,且其下游信号转导机制也不清楚,鲜有关于GpR149生理功能的报道。为研究GpR149的功能,团队构建了GpR149敲除的小鼠。在发育过程中,GpR149敲除小鼠髓鞘的发育比同窝野生型小鼠提前。GpR149敲除对OpC的增殖没有明显影响,而是促进OpC向成熟OL的分化效率,并增强髓鞘形成。在Cuprizone诱导的脱髓鞘动物模型中,GpR149敲除可显著增强髓鞘的再生修复(图1)。研究团队早期发现并报道抑制MApK/ERK信号通路可促进OpC向OL的分化和髓鞘再生修复(Glia, 2019;67(7):1320-1332)。MApK/ERK信号通路也常被GpCR调控,研究团队发现过表达GpR149可以激活ERK1/2,并抑制OpC的分化。而MEK抑制剂pD0325901可以抑制ERK1/2,并解除GpR149对OpC分化的抑制作用。该研究表明GpR149可能通过激活MApK/ERK负向调控髓鞘的发育与再生(图2)。本研究提示GpR49的抑制剂有可能用于脱髓鞘疾病的治疗。
在中枢神经系统中,髓鞘由少突胶质细胞(Oligodendrocyte,OL)形成。在发育的过程中,少突胶质细胞前体细胞(Oligodendrocyte precursor cell, OpC)通过多个阶段的转变分化为成熟的少突胶质细胞。在成体中OpC也广泛存在且数量丰富。通过系统筛选表达于OpC及OL的GpCR,研究团队发现GpR149高表达于OpC,且在OpC向OL分化的过程中表达量下调,提示GpR149可能参与调控OpC的分化。 GpR149是一个孤儿受体,没有已知配体,且其下游信号转导机制也不清楚,鲜有关于GpR149生理功能的报道。为研究GpR149的功能,团队构建了GpR149敲除的小鼠。在发育过程中,GpR149敲除小鼠髓鞘的发育比同窝野生型小鼠提前。GpR149敲除对OpC的增殖没有明显影响,而是促进OpC向成熟OL的分化效率,并增强髓鞘形成。在Cuprizone诱导的脱髓鞘动物模型中,GpR149敲除可显著增强髓鞘的再生修复(图1)。研究团队早期发现并报道抑制MApK/ERK信号通路可促进OpC向OL的分化和髓鞘再生修复(Glia, 2019;67(7):1320-1332)。MApK/ERK信号通路也常被GpCR调控,研究团队发现过表达GpR149可以激活ERK1/2,并抑制OpC的分化。而MEK抑制剂pD0325901可以抑制ERK1/2,并解除GpR149对OpC分化的抑制作用。该研究表明GpR149可能通过激活MApK/ERK负向调控髓鞘的发育与再生(图2)。本研究提示GpR49的抑制剂有可能用于脱髓鞘疾病的治疗。 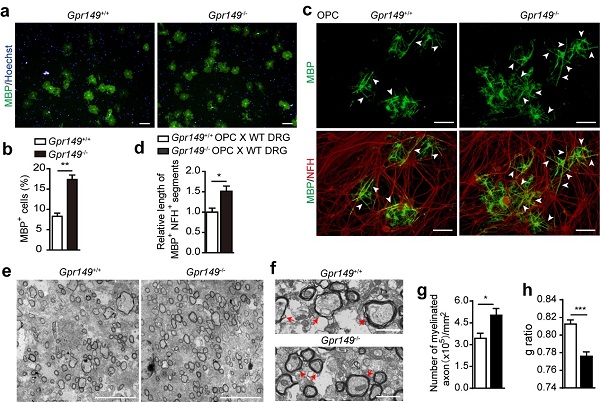 图1. (a, b)GpR149 KO 促进OpC在体外向OL的分化;(c, d)GpR149 KO 促进OpC和DRG神经元共培养体系中髓鞘的包裹;(e-h)电镜图片显示GpR149 KO 促进Cuprizone诱导的脱髓鞘小鼠模型鼠髓鞘的再生和修复。
图1. (a, b)GpR149 KO 促进OpC在体外向OL的分化;(c, d)GpR149 KO 促进OpC和DRG神经元共培养体系中髓鞘的包裹;(e-h)电镜图片显示GpR149 KO 促进Cuprizone诱导的脱髓鞘小鼠模型鼠髓鞘的再生和修复。 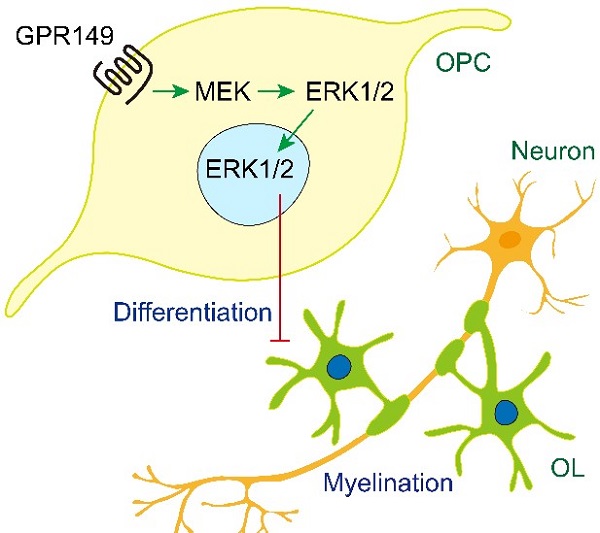 图2. GpR149调控髓鞘发育与再生示意图 本研究的第一作者为上海药物所博士后索娜,通讯作者为谢欣研究员。本研究工作得到科技部脑科学与类脑研究重大项目、中科院器官重建与制造先导专项及国家自然科学基金的支持。 谢欣课题组长期从事GpCR及干细胞相关的研究。在髓鞘再生方向,团队发现Kappa阿片受体的激活有利于OL的分化及髓鞘的再生(Nature Communications, 2016;7:13594),维生素C,MApK抑制剂及抗AD老药多奈哌齐等均可促进OpC向OL的分化及髓鞘再生(Glia, 2019;67(7):1320-1332; Glia, 2018;66:1302–1316; ApS, 2019;40(11):1386-1393)。 原文链接:https://onlinelibrary.wiley.com/doi/10.1002/glia.24233 (供稿人:谢欣课题组)
图2. GpR149调控髓鞘发育与再生示意图 本研究的第一作者为上海药物所博士后索娜,通讯作者为谢欣研究员。本研究工作得到科技部脑科学与类脑研究重大项目、中科院器官重建与制造先导专项及国家自然科学基金的支持。 谢欣课题组长期从事GpCR及干细胞相关的研究。在髓鞘再生方向,团队发现Kappa阿片受体的激活有利于OL的分化及髓鞘的再生(Nature Communications, 2016;7:13594),维生素C,MApK抑制剂及抗AD老药多奈哌齐等均可促进OpC向OL的分化及髓鞘再生(Glia, 2019;67(7):1320-1332; Glia, 2018;66:1302–1316; ApS, 2019;40(11):1386-1393)。 原文链接:https://onlinelibrary.wiley.com/doi/10.1002/glia.24233 (供稿人:谢欣课题组)
 在中枢神经系统中,髓鞘由少突胶质细胞(Oligodendrocyte,OL)形成。在发育的过程中,少突胶质细胞前体细胞(Oligodendrocyte precursor cell, OpC)通过多个阶段的转变分化为成熟的少突胶质细胞。在成体中OpC也广泛存在且数量丰富。通过系统筛选表达于OpC及OL的GpCR,研究团队发现GpR149高表达于OpC,且在OpC向OL分化的过程中表达量下调,提示GpR149可能参与调控OpC的分化。 GpR149是一个孤儿受体,没有已知配体,且其下游信号转导机制也不清楚,鲜有关于GpR149生理功能的报道。为研究GpR149的功能,团队构建了GpR149敲除的小鼠。在发育过程中,GpR149敲除小鼠髓鞘的发育比同窝野生型小鼠提前。GpR149敲除对OpC的增殖没有明显影响,而是促进OpC向成熟OL的分化效率,并增强髓鞘形成。在Cuprizone诱导的脱髓鞘动物模型中,GpR149敲除可显著增强髓鞘的再生修复(图1)。研究团队早期发现并报道抑制MApK/ERK信号通路可促进OpC向OL的分化和髓鞘再生修复(Glia, 2019;67(7):1320-1332)。MApK/ERK信号通路也常被GpCR调控,研究团队发现过表达GpR149可以激活ERK1/2,并抑制OpC的分化。而MEK抑制剂pD0325901可以抑制ERK1/2,并解除GpR149对OpC分化的抑制作用。该研究表明GpR149可能通过激活MApK/ERK负向调控髓鞘的发育与再生(图2)。本研究提示GpR49的抑制剂有可能用于脱髓鞘疾病的治疗。
在中枢神经系统中,髓鞘由少突胶质细胞(Oligodendrocyte,OL)形成。在发育的过程中,少突胶质细胞前体细胞(Oligodendrocyte precursor cell, OpC)通过多个阶段的转变分化为成熟的少突胶质细胞。在成体中OpC也广泛存在且数量丰富。通过系统筛选表达于OpC及OL的GpCR,研究团队发现GpR149高表达于OpC,且在OpC向OL分化的过程中表达量下调,提示GpR149可能参与调控OpC的分化。 GpR149是一个孤儿受体,没有已知配体,且其下游信号转导机制也不清楚,鲜有关于GpR149生理功能的报道。为研究GpR149的功能,团队构建了GpR149敲除的小鼠。在发育过程中,GpR149敲除小鼠髓鞘的发育比同窝野生型小鼠提前。GpR149敲除对OpC的增殖没有明显影响,而是促进OpC向成熟OL的分化效率,并增强髓鞘形成。在Cuprizone诱导的脱髓鞘动物模型中,GpR149敲除可显著增强髓鞘的再生修复(图1)。研究团队早期发现并报道抑制MApK/ERK信号通路可促进OpC向OL的分化和髓鞘再生修复(Glia, 2019;67(7):1320-1332)。MApK/ERK信号通路也常被GpCR调控,研究团队发现过表达GpR149可以激活ERK1/2,并抑制OpC的分化。而MEK抑制剂pD0325901可以抑制ERK1/2,并解除GpR149对OpC分化的抑制作用。该研究表明GpR149可能通过激活MApK/ERK负向调控髓鞘的发育与再生(图2)。本研究提示GpR49的抑制剂有可能用于脱髓鞘疾病的治疗。  图1. (a, b)GpR149 KO 促进OpC在体外向OL的分化;(c, d)GpR149 KO 促进OpC和DRG神经元共培养体系中髓鞘的包裹;(e-h)电镜图片显示GpR149 KO 促进Cuprizone诱导的脱髓鞘小鼠模型鼠髓鞘的再生和修复。
图1. (a, b)GpR149 KO 促进OpC在体外向OL的分化;(c, d)GpR149 KO 促进OpC和DRG神经元共培养体系中髓鞘的包裹;(e-h)电镜图片显示GpR149 KO 促进Cuprizone诱导的脱髓鞘小鼠模型鼠髓鞘的再生和修复。  图2. GpR149调控髓鞘发育与再生示意图 本研究的第一作者为上海药物所博士后索娜,通讯作者为谢欣研究员。本研究工作得到科技部脑科学与类脑研究重大项目、中科院器官重建与制造先导专项及国家自然科学基金的支持。 谢欣课题组长期从事GpCR及干细胞相关的研究。在髓鞘再生方向,团队发现Kappa阿片受体的激活有利于OL的分化及髓鞘的再生(Nature Communications, 2016;7:13594),维生素C,MApK抑制剂及抗AD老药多奈哌齐等均可促进OpC向OL的分化及髓鞘再生(Glia, 2019;67(7):1320-1332; Glia, 2018;66:1302–1316; ApS, 2019;40(11):1386-1393)。 原文链接:https://onlinelibrary.wiley.com/doi/10.1002/glia.24233 (供稿人:谢欣课题组)
图2. GpR149调控髓鞘发育与再生示意图 本研究的第一作者为上海药物所博士后索娜,通讯作者为谢欣研究员。本研究工作得到科技部脑科学与类脑研究重大项目、中科院器官重建与制造先导专项及国家自然科学基金的支持。 谢欣课题组长期从事GpCR及干细胞相关的研究。在髓鞘再生方向,团队发现Kappa阿片受体的激活有利于OL的分化及髓鞘的再生(Nature Communications, 2016;7:13594),维生素C,MApK抑制剂及抗AD老药多奈哌齐等均可促进OpC向OL的分化及髓鞘再生(Glia, 2019;67(7):1320-1332; Glia, 2018;66:1302–1316; ApS, 2019;40(11):1386-1393)。 原文链接:https://onlinelibrary.wiley.com/doi/10.1002/glia.24233 (供稿人:谢欣课题组) 郑重声明:文章仅代表原作者观点,不代表本站立场;如有侵权、违规,可直接反馈本站,我们将会作修改或删除处理。
相关阅读
猜你喜欢
-
科学家成功获取奥氏马全基因组数据
2022-07-26 -
上海交大王如竹教授团队展望太阳能驱动连续式空气取水
2022-07-26 -
上海交大电院周健军教授课题组在模数转换器芯片研究中取得重要进展
2022-07-26 -
我国学者与海外合作者在强韧化氧化石墨烯基复合块体材料制备领域取得进展
2022-07-26 -
上海交大电院朱卫仁课题组发表超表面加密最新研究成果
2022-07-26 -
物理学院许甫荣团队与合作者有关四中子态能量和共振宽度的理论预言被实验证实
2022-07-26