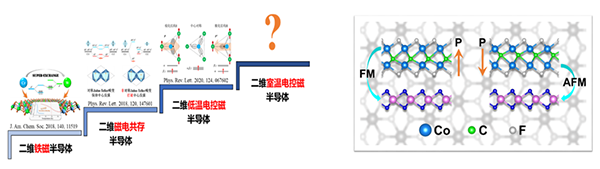
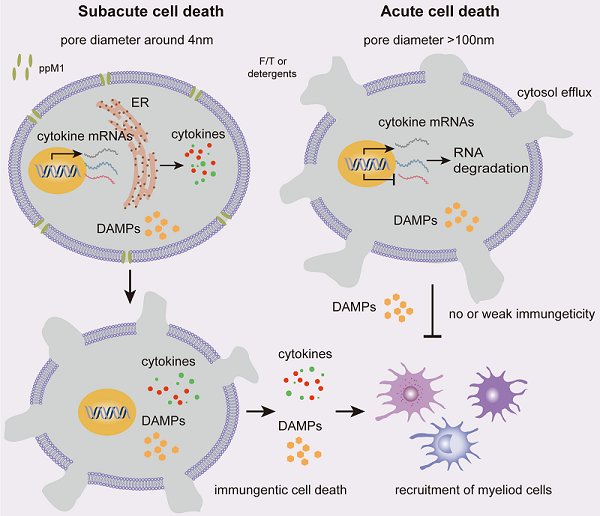
我国学者在二维材料磁电耦合理论研究方面取得进展
pOGZ是一个在小鼠早期胚胎发育时期广泛表达的转录因子,尤其在胚胎大脑皮层表达强烈,提示其在大脑发育过程中的重要作用。与另外一个自闭症高风险基因ADNp类似(Sun et al., Nature Communications),pOGZ突变亦会引发罕见的神经发育障碍性疾病-怀特-萨顿综合征(White-sutton syndrome)。患者往往表现出发育迟缓、不同程度的智力残疾、特定的面部特征,大部分的病人都表现出典型的自闭症特征。然而,pOGZ突变引发的神经发育障碍性疾病的病理仍然不清楚。
近日,中国科学院水生生物研究所孙玉华研究员团队以小鼠胚胎干细胞(mouse embryonic stem cells, ESCs)为模型,揭示了pOGZ通过染色质重塑复合物esBAF参与调控ESCs的干性和神经诱导的分子机制。
研究人员发现,ESCs中敲除pOGZ后,ESCs的自我更新和增殖受到严重损害,伴随干性相关基因表达显著降低以及发育分化相关基因的表达显著升高(图1)。
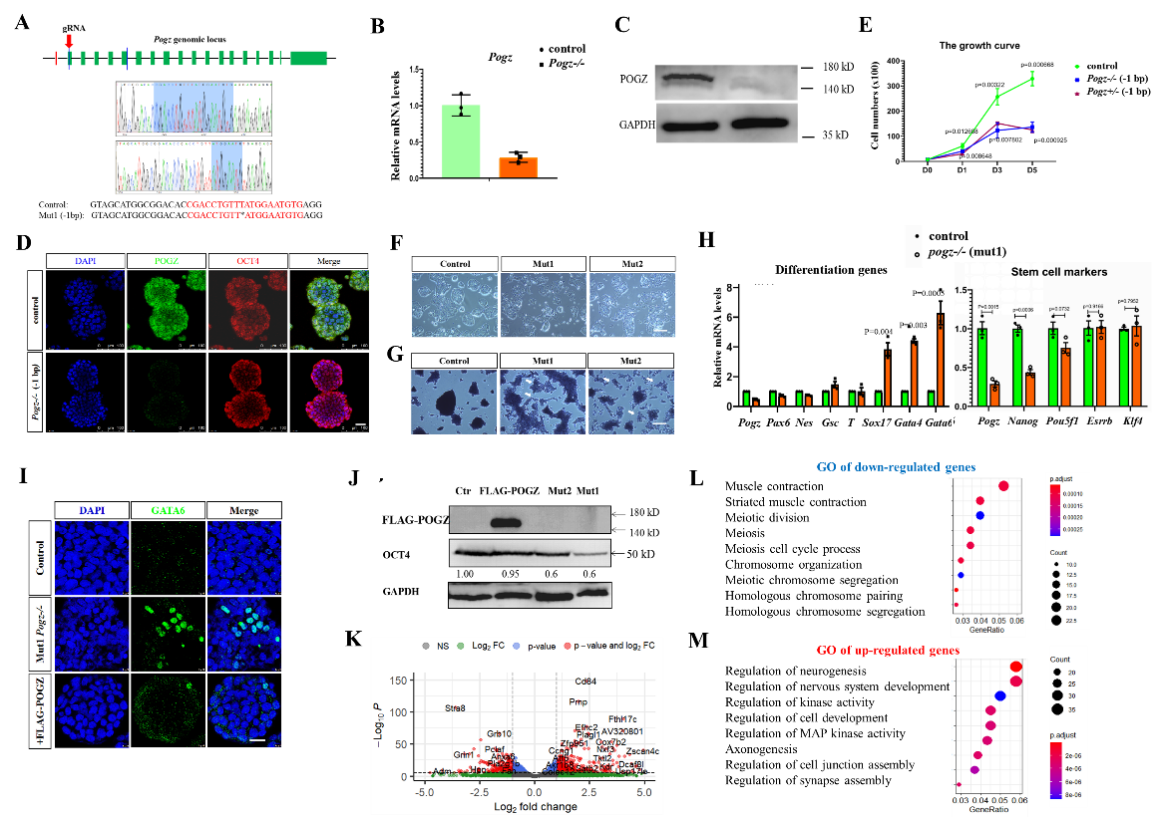
图1:pOGZ缺失影响ESCs自我更新
重要的是,在ESC向神经前体细胞诱导过程中,pOGZ功能缺失显著抑制神经前体基因的表达,导致神经诱导和发育异常(图2)。
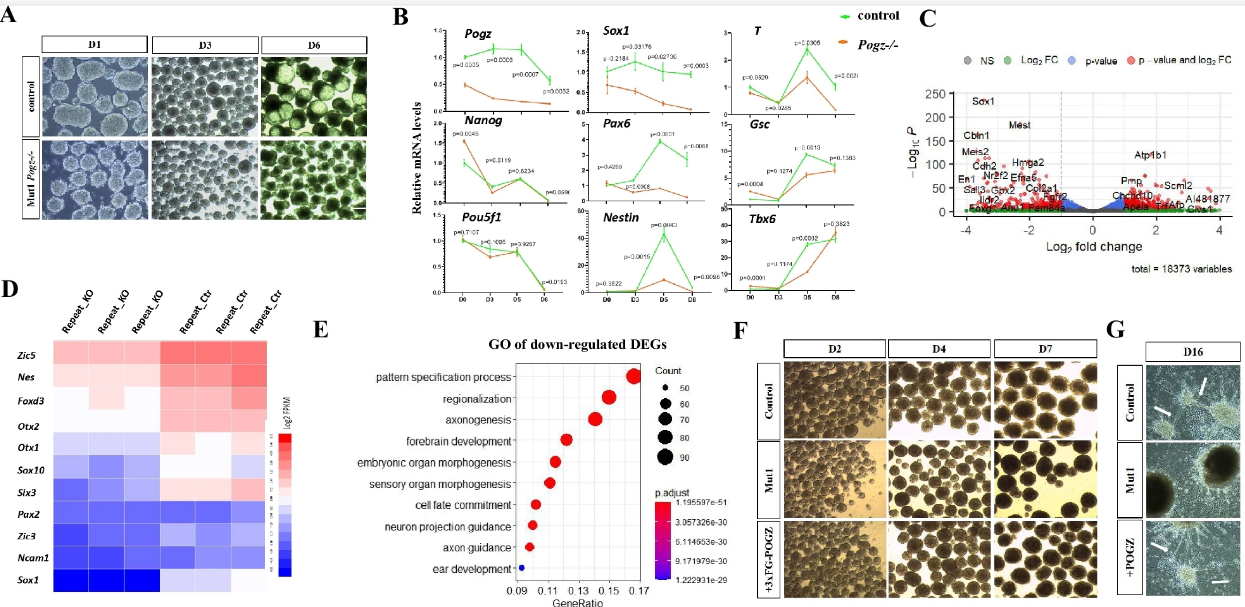
图2:pOGZ缺失导致神经发育异常
全基因组结合分析发现,pOGZ显著定位于基因的启动子和增强子区域(图3)。 进一步研究发现,pOGZ可以与SWI-SNF (esBAF)染色质重塑复合物的核心组分BRG1/BAF155互作(图4),并且在基因的启动子和增强子区域共定位。
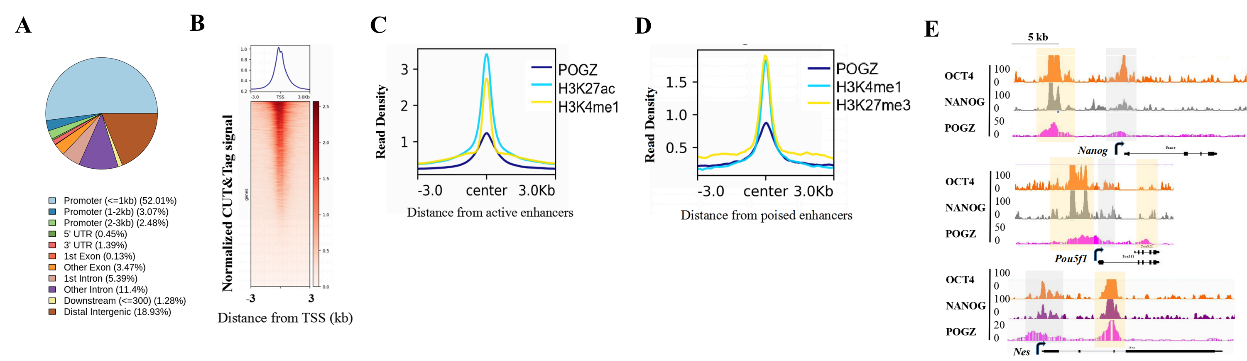
图3:pOGZ主要定位于基因的启动子和增强子区域
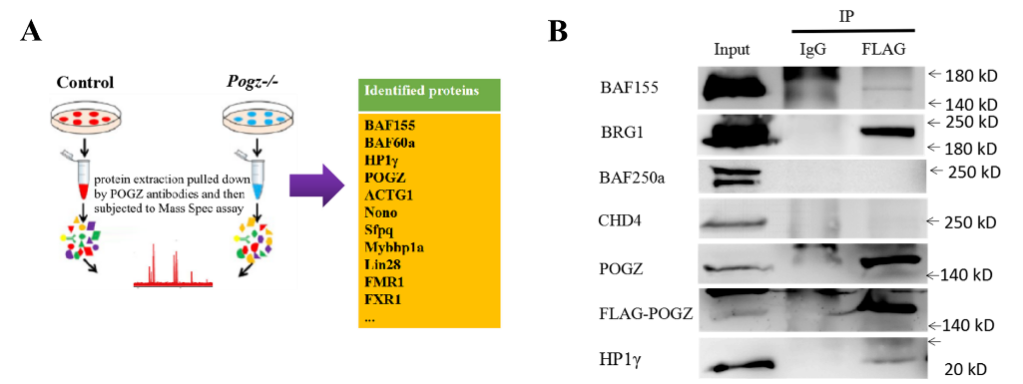
图4:pOGZ与esBAF核心组分互作
在干性条件下,pOGZ通过与BRG1互作,通过调节增强子活性促进干性基因的表达,从而维持胚胎干细胞不分化;在神经诱导过程中,pOGZ招募esBAF复合物到神经早期发育基因的增强子区域,促进基因的表达,确保神经诱导和分化的正常进行(图5)。
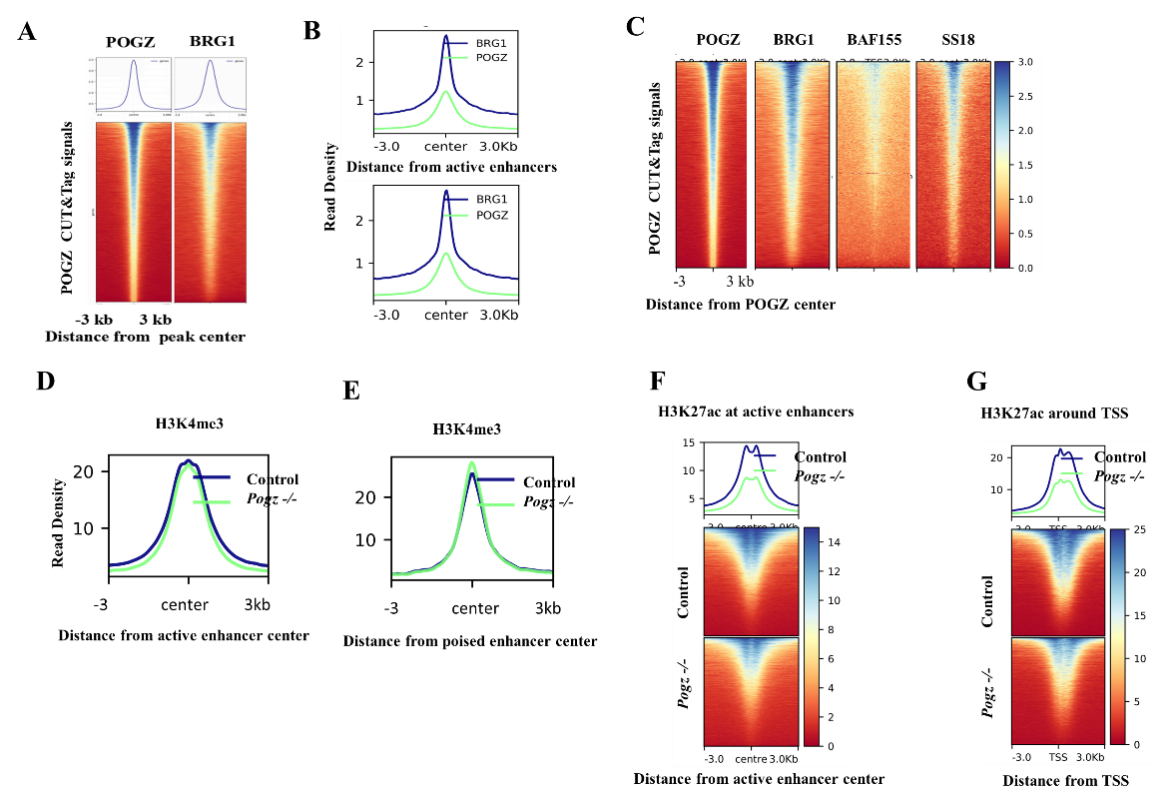
图5:pOGZ招募BRG1促进神经诱导
该研究发现pOGZ通过与esBAF复合物互作参与神经诱导分化的机制,而BAF复合物活性异常已被广泛证实与多种神经系统发育缺陷有关。研究成果为pOGZ突变导致的神经系统发育障碍性疾病提供了新的重要见解。
该项工作近日以“Autism-associated protein pOGZ controls ESCs and ESC neural induction by association with esBAF”为题,在线发表在Molecular Autism期刊上。水生所孙玉华研究员为论文通讯作者,项目副研究员孙晓云和博士生程麟茜为论文共同第一作者。该研究得到国家重点研发项目的资助。
文章链接:https://molecularautism.biomedcentral.com/articles/10.1186/s13229-022-00502-9
-
华南植物园“黑果枸杞LrNOR基因及其蛋白的应用”获发明专利
2022-07-26 -
我国学者在运动促进骨形成和提高免疫力研究方面取得进展
2022-07-26 -
新的小麦穗发育调控基因
2022-07-26 -
Nature子刊:哺乳动物卵子以及早期胚胎翻译组研究
2022-07-26 -
生命学院江鹏课题组发现延胡索酸调控B细胞的机制和功能
2022-07-26 -
细胞培养肉丸技术:基于多孔明胶微载体的细胞高效扩增和模块化生物组装
2022-07-26 -
Cell Insight | 我室蓝柯/陈宇等综述新冠病毒突变体的进化动力和突变特征
2022-07-26 -
乐敏实验室在ANTIBIOTICS-BASEL发表论文
2022-07-26 -
刘红云实验室在ANIMAL NUTRITION发表论文
2022-07-26 -
昆明植物所在全球农林复合系统的减排固碳潜力研究中取得进展
2022-07-26