信号“压力过大”植物
弥漫内生性脑桥胶质瘤(Diffuse Intrinsic pontine Glioma, DIpG)是一种发生在脑干桥脑部位的,呈弥散性生长、不易手术切除、无有效治疗药物、死亡率高的儿童肿瘤。大约80%的DIpG中,肿瘤发生的驱动因素来自组蛋白H3.1K27M和H3.3K27M 突变。其中H3.3K27M突变病人预后最差,而H3.1K27M 突变病人有更长的生存期,两个DIpG亚群有着不同的致病机理和临床特征,所以分别研究这两个DIpG亚群的致病机制和潜在的治疗策略势在必行。骨形态发育蛋白(Bone Morphogenetic protein,BMp)信号通路会根据肿瘤细胞环境行使其抑制或促进肿瘤的作用。造成BMp信号通路自激活的ACVR1突变与H3.1K27M突变共同促进约20%的DIpG亚群肿瘤的发展,但BMp信号通路对占比60%的ACVR1野生型,H3.3K27M突变型 DIpG亚群的影响仍是未知。
2022年8月1日,清华大学生命科学学院郗乔然课题组和首都医科大学附属北京天坛医院张力伟课题组合作,在《自然 癌症》(Nature Cancer)上在线发表题为“BMp信号通路在弥漫内生性脑桥胶质瘤(DIpG)中的抑癌作用”(Context-dependent tumor suppressive BMp signaling in Diffuse Intrinsic pontine Glioma regulates stemness through epigenetic regulation of CXXC5)的研究论文,系统性地阐述了BMp信号通路在ACVR1野生型,H3.3K27M突变型弥漫内生性脑桥胶质瘤中的抑癌作用。
在此项研究中,研究人员首次系统性地研究了BMp信号通路在ACVR1野生型,H3.3K27M突变型弥漫内生性脑桥胶质瘤中的抑癌作用(图1)。首先,研究人员从现有的对此DIpG亚群的转录组分析中发现相对于正常脑桥祖细胞及正常脑桥组织,这一亚群DIpG细胞和组织都具有一致性相对低的BMp信号通路活性。接下来,研究人员利用未经放化疗治疗的病人来源的DIpG细胞系作为研究材料,通过生物信息学分析和实验验证相结合的方式,发现了ACVR1野生型,H3.3K27M突变型DIpG中高表达的BMp信号通路的拮抗因子CHRDL1是造成其中BMp信号通路异常下调的原因。高表达CHRDL1不仅和DIpG病人的不良预后正相关,而且实验证明CHRDL1是DIpG的促癌因子。进而,研究者展示了重新激活此DIpG亚群中BMp信号通路会通过SMADs蛋白发挥对DIpG体外和体内生长的抑癌作用。
进一步,研究人员通过转录组和表观遗传组分析探究了BMp信号通路在此DIpG亚群中发挥抑癌作用的分子机制:激活BMp信号通路驱使此DIpG亚群退出干细胞状态,促进细胞分化,引起细胞周期停滞和细胞凋亡。并且,研究人员鉴定出BMp信号通路通过表观遗传调控下游靶基因CXXC5发挥抑癌作用。最后,通过药物筛选的方法,研究人员找到了可以激活此DIpG亚群中BMp信号通路并可能作为治疗DIpG的小分子药物—Dacinostat。
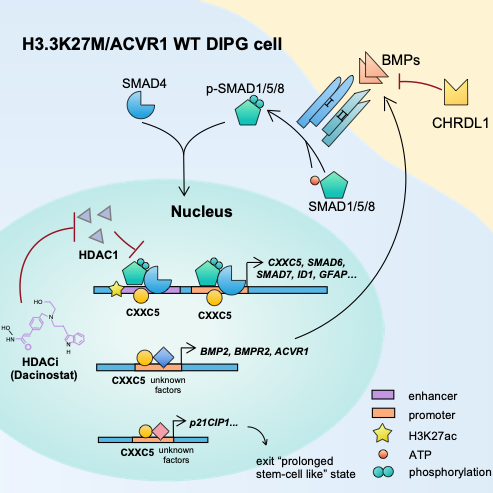
图1:BMp信号通路抑制H3.3K27M ACVR1 WT DIpG模式图
清华大学生命学院郗乔然副教授、首都医科大学附属北京天坛医院张力伟教授为论文共同通讯作者。清华大学2015级已毕业博士生孙晔,2016级已毕业博士生闫坤,以及首都医科大学附属北京天坛医院王一和徐骋,是本文的共一作者。感谢上海交通大学唐玉杰课题组及清华大学生命科学学院张强锋课题组为本研究的顺利开展做出的重要贡献。
本研究得到了国家自然科学基金、科技部国家重点研发计划、北京市自然科学基金和清华-北大生命科学联合中心的大力支持。
原文链接:https://www.nature.com/articles/s43018-022-00408-8
-
一个细胞接着一个细胞,科学家们构建阿尔茨海默氏症大脑变化的高分辨率地图
2022-08-06 -
雄性小鼠中HIV-1 Tat表达可促进与年龄相关的神经内分泌、认知和行为共病
2022-08-06 -
细胞中分子之间动态相互作用的光学成像
2022-08-06 -
肉毒杆菌毒素如何麻痹杀死细胞?
2022-08-06 -
挑战进化论:长读测序发现高达20%的果蝇基因来自细菌
2022-08-06 -
《Nature》噬菌体细胞核与人类细胞核的惊人相似性
2022-08-06 -
新的研究表明,导致致命脑瘤的基因也会导致儿童癌症
2022-08-06 -
脂肪肌肉质量比与老年痴呆发病风险
2022-07-30 -
《Nature》“肠漏假说”的一片关键拼图
2022-07-30 -
超加工食品可能“坏脑子”
2022-07-30