经过多年的延迟FDA批准了Teva的通用EpiPen
包括人在内的动物神经系统的信息传递需要前一级神经细胞通过分泌囊泡释放递质传给(激活)下一级细胞。包括神经在内的所有细胞需要分泌囊泡(30-200纳米大小,分为无核清亮型和有核致密DCV型两种)。DCV在神经和内分泌细胞的生理和疾病中都是至关重要的。
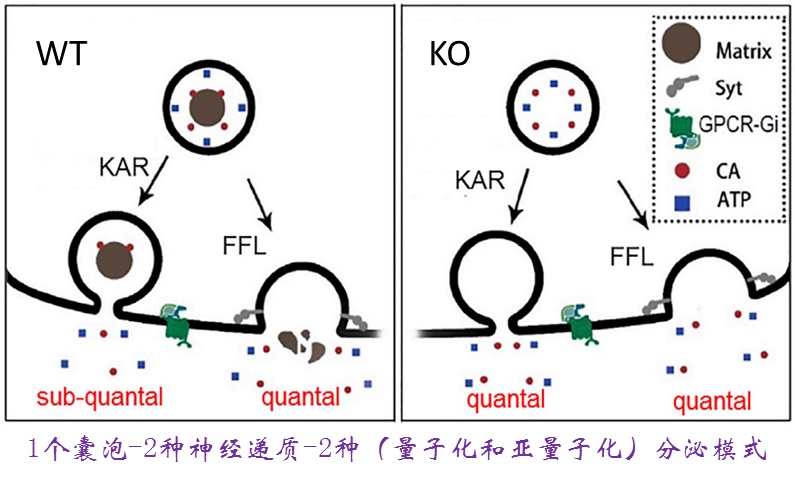
2019年2月14日,北京大学分子医学研究所、北大-清华生命科学联合中心、生物膜国家重点实验室、麦戈文(北大)脑科学研究所周专课题组在Neuron杂志在线发表题为“Differential co-release of two neurotransmitters from a vesicle fusion pore in mammalian adrenal chromaffin cells”的研究论文,发现1个囊泡纳米小孔同时释放的2种神经递质(肾上腺素CA和ATp),却通过2种量子分泌模式进行,从而揭示了“亚量子化(sub-quantal)”分泌的分子机理。
近年分泌研究揭示,一种神经细胞可分泌多种神经递质对下级细胞进行调控,但这些神经递质是否由同一囊泡共同分泌尚不确定。他们在小鼠神经内分泌ACC细胞上,首创使用尖端7-10微米的两个电极同时(分别)记录来自同一DCV的“量子化”CA和ATp分泌信号,却意外发现了“同途殊归”的奇异共分泌现象: CA 为“亚量子化”但ATp为“量子化”分泌。对此,他们用超分辨TIRFM显微成像,电子显微镜,荧光纳米粒,在动物和细胞水平基因操控(RNAi、KO),以及分子生化等实验进行了验证。
这项研究通过实时记录毫秒级“双量子”分泌,发现CA和ATp虽然同时从单个5纳米的小孔分泌出来,但却有不同的分子调控机理:是DCV内的核物质(matrix,它结合CA但不结合ATp)与分泌小孔 (fusion pore)共同决定CA为“亚量子”模式,而ATp总是“全量子”模式。该发现的一个推论是DCV分泌都是“双量子”模式。
周专小组25年前用自己发明的高灵敏电化学CFE电极首次发现亚量子分泌模式(Zhou et al, Biophys J, 1996),15年前发现第一个亚量子调孔蛋白Gibg(Chen et al, Nat Neurosci,2005),现在揭示了亚量子分泌的分子机理(Zhang et al, Neuron, 2019)。 “双量子分泌模式”基础研究为临床前神经、内分泌和代谢相关疾病治疗和药物研发提供了全新的靶点和机会。
北大-清华生命科学联合中心博士生张泉峰,北大分子医学研究所博士生刘斌、吴齐辉担任论文共同第一作者,周专教授为通讯作者。该研究获得科技部国家重点研发计划、北大-清华生命科学联合中心、国家自然科学基金委项目支持。
原文标题:
Differential co-release of two neurotransmitters from a vesicle fusion pore in mammalian adrenal chromaffin cells
-
合成微生物使科学家们能够研究古老的进化神秘
2022-04-29 -
加强了恰帕斯高地土着居民的领土管理合作进程
2022-04-29 -
介绍CNVP,IUCN的新成员
2022-04-29 -
销售人员为肥胖客户推荐更多圆形产品
2022-04-29 -
黄石麋鹿的疾病隐藏成本 USU生态学家说 布鲁氏菌病会减少怀孕
2022-04-29 -
研究人员设计“智能”表面以排斥一切 但针对有益的例外
2022-04-29 -
大麻使用的性别差异开始在动物和人类的大脑研究的帮助下得到解释
2022-04-29 -
缅甸开始在全国红色名单上工作
2022-04-29 -
转染市场五年后将达到10亿美元
2015-07-08