经过多年的延迟FDA批准了Teva的通用EpiPen
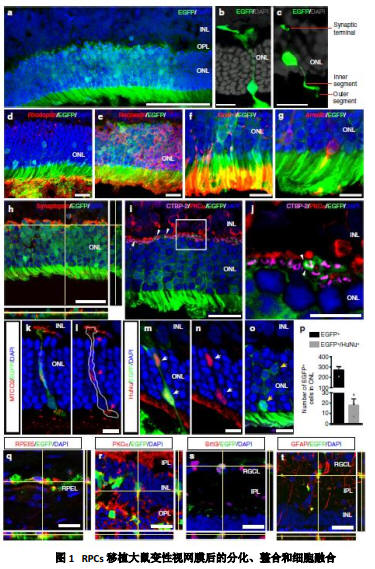
2019年3月14日,陆军军医大学第一附属医院眼科团队在Nature杂志旗下子刊Nature communications在线发表了题为“Organoid-derived C-Kit+/SSEA4− human retinal progenitor cells promote a protective retinal microenvironment during transplantation in rodents”的研究论文。
这一研究采用干细胞表面标记C-Kit结合胚胎抗原SSEA4分选策略从hESCs来源的视网膜类器官(Organoids)中筛选出了一群视网膜祖细胞(retinal progenitor cells, RpCs),这一分选策略排除了混杂在细胞中具有成瘤风险的早期胚胎细胞,具有重要的临床指导意义。
之后,研究人员将这些RpCs移植到视网膜变性大鼠和小鼠视网膜下腔后,这些植入的RpCs能分化为包括感光细胞在内的视网膜各类细胞,在较长的时间内改善了视网膜变性大鼠的视功能,其作用机制除了少部分的植入RpCs对变性感光细胞替代和整合作用外,主要是由于植入的RpCs通过抑制变性视网膜中因小胶质细胞过度激活而导致对炎症微环境的显著改善,以及通过抑制变性视网膜中Müller细胞增生而形成的胶质疤痕化微环境,从而主动营造了一个有利于植入干细胞长期存活和正确分化的微环境。
干细胞修复变性视网膜的这一作用机制也是对经典的干细胞治疗营养作用学说、细胞替代学说,以及近两年来新提出的细胞融合/物质交换学说的最新补充。
这一研究结果显示:植入变性视网膜的干细胞不仅仅受微环境的被动调控决定其命运,还可主动调节变性和损伤微环境,从而延长治疗时间。陆军军医大学第一附属医院眼科阴正勤教授和徐海伟教授为该文通讯作者,邹婷博士为该文第一作者。该研究得到国家重大科学研究计划、国家自然科学基金等资助。
全文链接:https://www.nature.com/articles/s41467-019-08961-0
Zou T,Gao LX,Zeng YX, Qiyou Li, Yijian Li, Siyu Chen, Xisu Hu, Xi Chen, Caiyun Fu, Haiwei Xu & Zheng Qin Yin. Organoid-derived C-Kit+/SSEA4− human retinal progenitor cells promote a protective retinal microenvironment during transplantation in rodents. Nat Commun. 2019. 10: 1205
-
合成微生物使科学家们能够研究古老的进化神秘
2022-04-29 -
加强了恰帕斯高地土着居民的领土管理合作进程
2022-04-29 -
介绍CNVP,IUCN的新成员
2022-04-29 -
销售人员为肥胖客户推荐更多圆形产品
2022-04-29 -
黄石麋鹿的疾病隐藏成本 USU生态学家说 布鲁氏菌病会减少怀孕
2022-04-29 -
研究人员设计“智能”表面以排斥一切 但针对有益的例外
2022-04-29 -
大麻使用的性别差异开始在动物和人类的大脑研究的帮助下得到解释
2022-04-29 -
缅甸开始在全国红色名单上工作
2022-04-29 -
转染市场五年后将达到10亿美元
2015-07-08