经过多年的延迟FDA批准了Teva的通用EpiPen
不想承认但不得不承认的事实是:癌症依然是全球主要的公共卫生问题,严重威胁人类生命健康。
而中国的情况更不容乐观。由于人口老龄化、工业化、生活方式改变等因素,我国每年癌症的发病数和死亡数分别占全球的23.7%和30%,并持续增加,癌症防控形势十分严峻[1]。
好在精准医疗概念的出现,为人类攻克癌症带来了希望。其中分子诊断成为发展最快的体外诊断细分领域,已进入多样化应用场景,如肿瘤伴随诊断、肿瘤早期筛查等等。
伴随诊断是靶向用药,实现精准医疗的关键,而NGS技术由于可在单一检测中同时分析与患者癌症相关的所有基因组改变及标志物,具有较高准确性,是未来的发展方向,市场前景广阔。
不过在我国,目前NGS伴随诊断的渗透率仍相对较低,仅有6.4%的晚期癌症患者和被建议基因分型的癌症患者采用了NGS伴随诊断检测(美国约23.5%)。从市场规模看,有机构预计2030年中国NGS肿瘤伴随诊断市场规模将达到约45亿美元,而2019年这一数据估计为3亿美元[2],存在巨大的增长空间。
因此,众多厂商纷纷投身这一蓝海市场,推出具有自身特色的NGS伴随诊断服务。
通过公开途径调查,小编发现仅寥寥几家厂商推出了基于RNA水平的NGS检测,绝大多数厂商的服务都基于DNA水平。因此,目前DNA-Seq是业内采用的主流技术。
不过,在与一些头部厂商交流时,小编留意到部分厂商开始计划或正在研发、优化RNA水平的伴随诊断NGS项目,并且项目有一个共同点——融合基因检测!
那么融合基因检测缘何受到关注?相较于DNA水平,RNA水平的融合基因检测又有何优势?
跟着小编一起来解密。
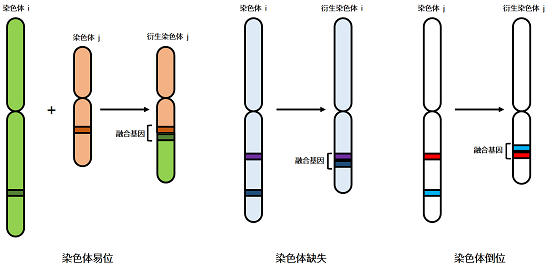
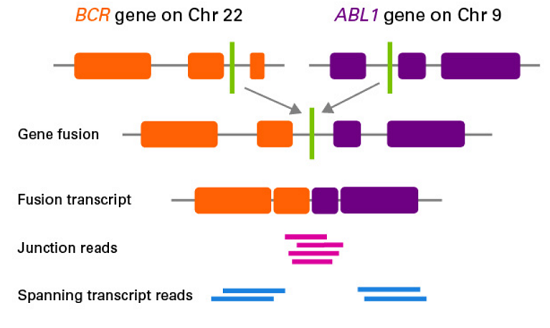
融合基因是指两个基因的编码区首尾相连构成的嵌合基因,即由两个基因的部分序列拼接在一起形成的,其表达产物为融合转录本。主要是由染色体易位、缺失或倒位所致。
可以看出,融合基因是由染色体变异所致,而且发生融合的基因往往是癌症驱动基因[3]。当调控细胞增殖、分化和凋亡的基因发生融合,能直接影响下游信号传递,其结果是细胞增殖能力增强、凋亡与分化出现障碍,最终引起癌症的发生。此外,基因融合还可能会激活原癌基因、失活抑癌基因[4],导致癌症发生。
因此,融合基因与癌症的发生存在比较强的关联,深入研究基因融合事件可以有效预防癌症,或进行精确诊断。此外,虽然基因融合的发生率相对于其他种类的突变类型较低,但相关靶向药物的疗效却很显著。基于此,NCCN指南已建议对多个融合基因进行检测分析。
与传统的RT-pCR、荧光原位杂交(FISH)、免疫组化(IHC)等检测技术相比,NGS技术由其更高的实验通量、特异性和灵敏度,在未知融合基因、低表达基因融合事件的发现中具备更广袤的应用前景,推动了融合基因检测进入新时代。
对融合基因的NGS检测,既可以采用DNA-Seq,也可以采用RNA-Seq。虽说如此,有时在RNA水平检出的基因融合事件却不能在DNA水平被检出(如剪切水平融合),如果此时只做DNA水平的融合检测,很大可能会产生假阴性的结果。
研究表明:在灵敏度、特异性及复杂结构融合检出等评价指标中,RNA-Seq优于DNA-Seq,能提供更准确的融合基因检测结果[5]。
所以,从RNA水平检测融合基因并用于伴随诊断,开始受到更多关注。
那么,哪些样本类型在融合基因RNA-Seq项目中具有应用潜力呢?
答案是FFpE和游离RNA样本↓
FFpE,即福尔马林固定石蜡包埋样本,是一种先用福尔马林固定,再用石蜡包埋的临床组织样本。由于可在常温情况下长期保存,全球样本库存有约数亿份FFpE样本,用于组织学诊断及研究使用。
作为一种存量大、且“容易”获取的样本,NGS技术的出现与发展赋予了FFpE样本更大的应用潜力,为回顾性研究、阐明疾病发病机理、Biomarker筛查、预后指示等提供了宝贵的数据。
但是,福尔马林固定样本时,组织中的核酸容易发生不同程度的降解与分子间交联,石蜡的高温渗入又进一步加速核酸的降解,保存时间及环境对核酸也有不小影响。因此FFpE RNA常常存在完整性不足、品质差的问题,故较难用于后续NGS分析。
再来看看游离RNA样本。
近几年液态活检技术蓬勃发展,众多第三方检测机构推出了基于ctDNA的肿瘤NGS服务,用于早筛、伴随诊断、指导用药。随着研究的深入,不少从业人员又纷纷将目光聚焦游离RNA,试图从RNA水平明确肿瘤在特定时间发生的变化、评判患者对治疗的反应等。
游离RNA,又称cfRNA,是存在于人体循环系统中一些内源性或外源性微量RNA片段,包括mRNA、miRNA和lncRNA等。由于在体外易被RNA酶降解,cfRNA完整性常常较低;加之提取的cfRNA常处于微量范畴,为科研工作者NGS分析这类样本增加难度。
面临这两类蕴藏巨大价值,又困难重重的样本,是坚持到底,还是放弃融合基因RNA-Seq项目呢?
若不愿放弃,那该如何应对呢?
小编给您支点招:
一般建议从源头把控,如选择合适的核酸提取方案,以获得足量RNA用于下游应用;并规范样本的取样操作及保存条件、减少RNA降解的风险。
不过,有些样本确实比较特殊又珍贵,优化提取方案或提升操作规范仍不能解决问题。这时还可考虑优化文库构建环节。
选择合适的文库构建试剂盒一般要关注:(划个重点,要考)
(1)灵敏性:是否支持微量RNA样本起始,检出更多的基因
(2)兼容性:能否兼容不同品质的RNA样本,如RIN值2-10的样本
(3)重复性:结果是否可重复
(4)简便性:rRNA去除与建库步骤是否能顺利整合、操作简便
小编按照上述“选择指南”,比较了各大试剂厂商提供的RNA建库方案,又向一些业内专业人士请教,发现下面这款试剂盒,适合用于FFpE 、cfRNA样本的建库,及下游的NGS分析↓
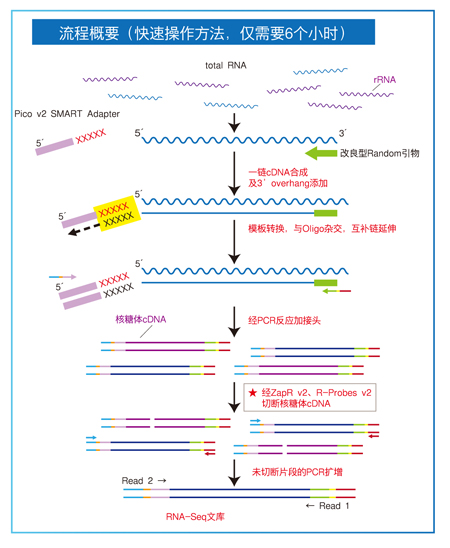
Takara公司的SMARTer® Stranded Total RNA-Seq Kit v2 - pico Input Mammalian (pico v2)!
我们一起看看这款产品如何解决FFpE、cfRNA样本降解、微量建库的难题。
首先,pico v2支持250 pg-10 ng 人、大/小鼠total RNA,或5-50 ng FFpE RNA起始,即使珍贵的微量临床样本,也无需过于担心样本量不足。
其次,pico v2采用随机引物,支持RIN2-10,或DV200≥25%的RNA起始,无论是品质较好还是高度降解的FFpE、cfRNA样本,都能生成优质的文库。
最后,pico v2还创新性的引入了ZapR Rprobes探针加酶法的核糖体去除技术,可实现在建库过程中识别、切断核糖体来源的cDNA,而无需您前处理rRNA,最终可在6h内完成链特异性Illumina文库的构建。
来看两个实际的应用案例:
▪FFpE RNA-Seq实验案例
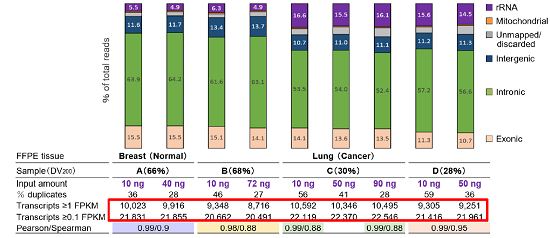
为了探讨pico v2能否应对不同起始量、不同降解程度的FFpE RNA建库,Takara科学家选取了4例FFpE来源的RNA样本(起始量为10-90 ng,DV200值在28%-68%之间),采用pico v2制备文库,并获得如下测序数据:↓
(实验数据来源:Takara Bio USA, Inc.)
从数据中我们可以看出,①无论RNA起始量高低,或降解是否严重,pico v2均能获得约10000的转录本检出数(FpKM≥1),说明pico v2具备足够高的灵敏度;②同一样本不同起始量之间数据的相关性系数达到0.99,说明pico v2所制备的文库具备高度的可重复性;③再来看看rRNA的残留情况,依照降解程度不同,rRNA残留有所差异,但整体保持在5~16%左右,处于较低的水平,说明ZapR Rprobes技术可以有效去除rRNA干扰!
因此,使用pico v2可成功制备降解严重的FFpE RNA文库,用于下游NGS分析,如融合基因分析等。
▪cfRNA-Seq文献案例
不同样本来源的cfRNA,不光在提取收量上有所差异,其分子特性也区别甚大,这就需要建库试剂盒具备兼容不同来源cfRNA的能力。
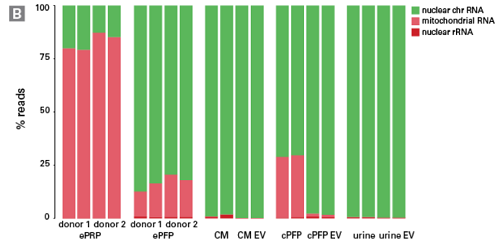
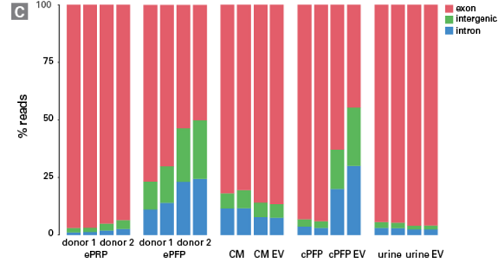
来自根特大学的科研人员与Biogazelle公司合作开展一项研究[6],探讨不同来源的cfRNA分子特性的差异。科研人员选取含血小板血浆(epRp)、不含血小板血浆(epFp)、细胞培养上清(CM)、尿液(urine)、及上述几种体液分离的细胞外囊泡,提取RNA并采用pico v2构建文库、测序↓
结果显示,不同样本来源的cfRNA,测序reads分布有明显差异。其中,含血小板血浆cfRNA超过75% reads比对到线粒体来源RNA,而不含血小板血浆cfRNA绝大多数reads比对到细胞核DNA。并且,不同类型cfRNA的内含子、外显子、基因间隔区的reads占比也有较大不同。
这些结果表明:面对不同样本提取的cfRNA,pico v2都可以胜任文库构建的任务!
看到这里,相信大家对融合基因的应用潜能,FFpE RNA和cfRNA的建库方案已有了初步的认识,或许现在就想用pico v2助力RNA-Seq项目的研发。
先别着急!
近期,Takara对产品进行了升级,推出了pico v3。在保留pico v2可靠性能的基础上,pico v3加入了UMI分子标签,更适合从RNA水平检测罕见融合基因、低频突变等应用。
大家如果对低频变异、结果准确度有更高要求,不妨关注带UMI的pico v3。
点击文末链接就可以详细了解pico v3的介绍、性能数据等内容,小编只能帮到这儿了。
参考文献及信息来源:
[1] 曹毛毛,陈万青. 中国恶性肿瘤流行情况及防控现状[J].中国肿瘤临床, 2019
[2] 2020国内NGS肿瘤伴随诊断市场报告,搜狐网, 2020-09-23
[3] Nicola Valeri. Streamlining detection of fusion genes in colorectal cancer: Having “Faith” in precision oncology in the (Tissue) “Agnostic” era [J]. Cancer Res 2019;79:1041-1043
[4] Tomlins S A, Rhodes D R, perner S, et al. Recurrent fusion of TMpRSS2 and ETS transcription factor genes in prostate cancer [J]. Science, 2005, 310(5748): 644-648
[5] Davies, K.D. & Aisner, D.L. Wake up and smell the fusions: Single-modality molecular testing misses drivers. Clin Cancer Res 25, 4586-4588 (2019)
[6] Everaert, C. et al. performance assessment of total RNA sequencing of human biofluids and extracellular vesicles. Sci. Reps.9, 17574 (2019)
了解更多产品详情请点击:
Takara Bio中国官网
-
合成微生物使科学家们能够研究古老的进化神秘
2022-04-29 -
加强了恰帕斯高地土着居民的领土管理合作进程
2022-04-29 -
介绍CNVP,IUCN的新成员
2022-04-29 -
销售人员为肥胖客户推荐更多圆形产品
2022-04-29 -
黄石麋鹿的疾病隐藏成本 USU生态学家说 布鲁氏菌病会减少怀孕
2022-04-29 -
研究人员设计“智能”表面以排斥一切 但针对有益的例外
2022-04-29 -
大麻使用的性别差异开始在动物和人类的大脑研究的帮助下得到解释
2022-04-29 -
缅甸开始在全国红色名单上工作
2022-04-29 -
转染市场五年后将达到10亿美元
2015-07-08