经过多年的延迟FDA批准了Teva的通用EpiPen
自噬是细胞应对营养缺乏的主要途径,同时也是MTOR信号通路调控的主要生物学过程之一。2017年,Sabatini课题组报道了BMT2/SAMTOR能够感知细胞内SAM(S-腺苷甲硫氨酸,S-adenosyl methionine)的浓度,在细胞缺乏SAM的时候,BMT2抑制MTOR信号通路,当SAM充足的时候,SAM则能够结合BMT2 避免BMT2对MTOR蛋白复合物的结合和抑制作用。
SAM是细胞内最主要的甲基供体,而SAH(S-腺苷同型半胱氨酸)则是SAM在甲基转移反应过程中的代谢产物。由于SAH和SAM结构非常类似,SAH对所有依赖于SAM的甲基转移酶具有很强的抑制作用。一般认为SAH一旦生成应该迅速被分解,避免抑制甲基转移反应。那么SAH是否有可能像SAM一样作为信号分子调控某些生物学过程呢?
2021年5月16日,我院雷群英团队在Autophagy杂志发表题为“AHCYL1 senses SAH to inhibit autophagy through interaction with pIK3C3 in an MTORC1-independent manner”的研究论文,发现了代谢物SAH通过AHCYL1(adenosylhomocysteinase like 1,类腺苷高半胱氨酸酶)抑制细胞自噬的分子机制,并且该调控过程不依赖于经典的MTOR信号通路。该研究发现AHCYL1可作为代谢物SAH的感受器(sensor),SAH不仅仅是一碳单位循环的中间产物,还可以作为信号分子通过AHCYL1调控自噬等生物学过程。

由于自噬能够直接应对细胞的营养缺乏状态,同时SAM和SAH的结构高度相似,于是推测SAH可能和SAM一样通过MTOR参与了细胞自噬的调控。由于SAM和SAH都不能自由穿越细胞膜,通过SAM合酶的抑制剂cLEU和AHCY的抑制剂ADOX分别降低胞内SAM的浓度和积累SAH。和之前的报道一致,减少SAM能够通过抑制MTOR激活自噬,而高浓度的SAH能够抑制自噬却不改变MTOR的活性。敲低AHCY也能够抑制细胞自噬。
进一步在多株细胞系中用ADOX和MTOR的抑制剂Torino1或Rapamycin共同处理细胞,发现ADOX抑制自噬确实不依赖于MTOR信号通路。于是推测细胞中存在SAH的感受器,并且该感受器调控自噬的靶点在MTOR-ULK1的下游。AHCY蛋白家族的另两个成员AHCYL1和AHCYL2都含有高度保守的AHCY-like结构域,却不具有水解SAH的酶活,可能是SAH的感受器。pIK3C3催化生成的ptdIns3p对于自噬体的形成非常重要,同时pIK3C3受到ULK1的调控。有文献报道pIK3C3可能是AHCYL1的结合蛋白,在验证了AHCYL1和pIK3C3的相互作用之后,推测SAH通过调控AHCYL1和pIK3C3的结合抑制自噬。进一步发现AHCYL1和SAH发生特异性结合,并且SAH显著增强AHCYL1和pIK3C3的相互作用,进而抑制pIK3C3的酶活,减少ptdIns3p的生成,从而抑制自噬。该调控机制在细胞以及斑马鱼中都得到了证实。
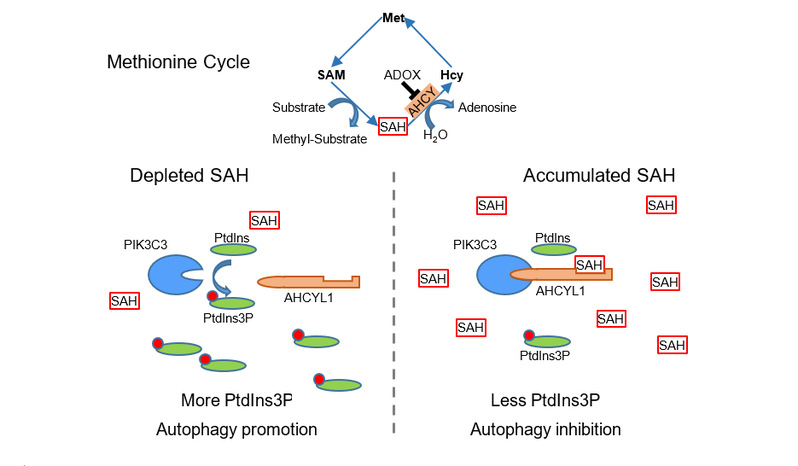
该研究发现了代谢物SAH的感受器AHCYL1,阐明了SAH除了作为代谢中间产物之外,还能够通过AHCYL1调控自噬等生物学过程。该发现不仅拓展了对细胞感知代谢物的认识,而且丰富了SAH的生物学功能。
雷群英教授为该文章通讯作者,博士后黄威和李娜为共同第一作者。该课题得到了国家重点研发计划,国自然重大、重点、面上、青年项目,上海市教委科创计划项目和中国博士后科学基金等资助。IBS的质谱平台对该研究给予了重要支持。
原文链接:https://doi.org/10.1080/15548627.2021.1924038
-
合成微生物使科学家们能够研究古老的进化神秘
2022-04-29 -
加强了恰帕斯高地土着居民的领土管理合作进程
2022-04-29 -
介绍CNVP,IUCN的新成员
2022-04-29 -
销售人员为肥胖客户推荐更多圆形产品
2022-04-29 -
黄石麋鹿的疾病隐藏成本 USU生态学家说 布鲁氏菌病会减少怀孕
2022-04-29 -
研究人员设计“智能”表面以排斥一切 但针对有益的例外
2022-04-29 -
大麻使用的性别差异开始在动物和人类的大脑研究的帮助下得到解释
2022-04-29 -
缅甸开始在全国红色名单上工作
2022-04-29 -
转染市场五年后将达到10亿美元
2015-07-08















