经过多年的延迟FDA批准了Teva的通用EpiPen
核膜蛋白是核膜各项功能职责的行使者,根据分布位置不同,被分为外核膜蛋白、内核膜蛋白以及核孔复合物三大类。目前已有功能报道的核膜蛋白不足百个,主要功能报道集中在细胞迁移与转移、核运动、有丝分裂、DNA 损伤修复、衰老,以及基因组稳定性调控等多种肿瘤发生发展相关领域,但具体调控机制并不清晰。新颖内核膜蛋白transmembrane protein 201 (TMEM201) 是新发现的位于内层核膜的多次跨膜整合蛋白,自被鉴定发现以来,在多项组学研究中被检测到,但尚未有任何关于其结构和功能的介绍。 2021年11月19日,中国科学院上海药物研究所李佳团队在国际知名期刊Oncogene杂志上在线发表了题为Inner nuclear membrane protein TMEM201 promotes breast cancer metastasis by positive regulating TGFβ signaling的研究成果。该项研究首次揭示TMEM201在乳腺癌转移过程中的正面调控作用和分子机制,即TMEM201通过直接相互作用促进TGFβ信号通路核心蛋白SMAD2/3的磷酸化,进而促进乳腺癌中EMT过程的发生,最终导致乳腺癌转移加重。 该研究中,科研人员首先通过包括TCGA在内的多个肿瘤表达数据库筛选发现表达水平与三阴性乳腺癌恶化显著性正相关的内核膜蛋白TMEM201,就此展开针对该蛋白对三阴性乳腺癌转移调控的系统性研究。结果显示,不论体外还是体内实验,TMEM201均表现出对乳腺癌肺转移的显著促进作用。 进一步的组学研究提示TMEM201参与介导乳腺癌转移重要信号通路——TGFβ信号通路,对TGFβ上下游核心介导因子的系统性考察结果显示,TMEM201的缺失可显著降低SMAD2/3的磷酸化水平,但并不影响其本底蛋白的表达水平。激光共聚焦实验和免疫共沉淀实验共同表明,TMEM201与SMAD2/3存在直接相互作用。 该项研究首次揭示了内核膜蛋白TMEM201的生物学功能,发现TMEM201通过与R-SMADs直接相互作用正向调控乳腺癌转移的发生与发展,进一步完善了对内核膜蛋白这类“神秘蛋白”功能调控网络的认识。 上海药物所博士后孔亚为本文独立第一作者,李佳研究员和臧奕研究员为本文共同通讯作者。上海药物所为该研究的第一完成单位。特别感谢复旦大学附属肿瘤医院柳素玲教授和上海药物所谭敏佳研究员提供的支持与帮助。该项研究获得了国家自然科学基金、上海市“超级博士后”激励计划和上海市科学技术委员会的资助。 全文链接:https://www.nature.com/articles/s41388-021-02098-5#Sec15 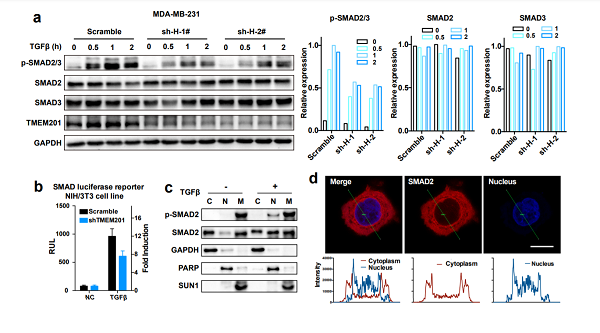 TMEM201缺失导致SMAD2/3磷酸化水平下降 (供稿部门:李佳课题组;供稿人:孔亚)
TMEM201缺失导致SMAD2/3磷酸化水平下降 (供稿部门:李佳课题组;供稿人:孔亚)
 TMEM201缺失导致SMAD2/3磷酸化水平下降 (供稿部门:李佳课题组;供稿人:孔亚)
TMEM201缺失导致SMAD2/3磷酸化水平下降 (供稿部门:李佳课题组;供稿人:孔亚) 郑重声明:文章仅代表原作者观点,不代表本站立场;如有侵权、违规,可直接反馈本站,我们将会作修改或删除处理。
相关阅读
猜你喜欢
-
合成微生物使科学家们能够研究古老的进化神秘
2022-04-29 -
加强了恰帕斯高地土着居民的领土管理合作进程
2022-04-29 -
介绍CNVP,IUCN的新成员
2022-04-29 -
销售人员为肥胖客户推荐更多圆形产品
2022-04-29 -
黄石麋鹿的疾病隐藏成本 USU生态学家说 布鲁氏菌病会减少怀孕
2022-04-29 -
研究人员设计“智能”表面以排斥一切 但针对有益的例外
2022-04-29 -
大麻使用的性别差异开始在动物和人类的大脑研究的帮助下得到解释
2022-04-29 -
缅甸开始在全国红色名单上工作
2022-04-29 -
转染市场五年后将达到10亿美元
2015-07-08















